|
||
|---|---|---|
|
|
||
|
Location:Home > 実験手法別製品・技術情報 > セルラーサイエンス |
||
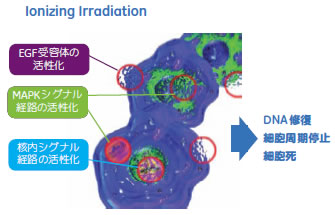
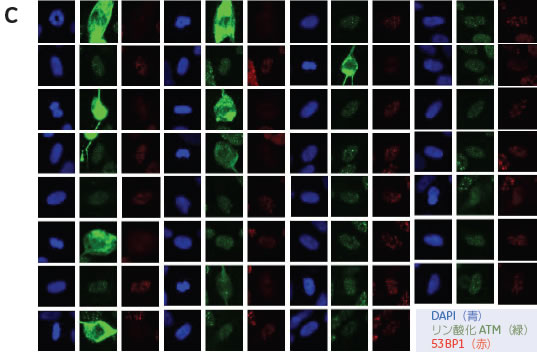
細胞周期と細胞内シグナル応答解析におけるイメージングサイトメトリーの有用性はじめに細胞に対する放射線照射は、細胞内シグナル伝達経路を介して細胞増殖や細胞死などの表現型を誘導します。近年、放射線ストレス応答の分子レベルでの要因として、EGF受容体の活性化や核内情報伝達経路の活性化が報告されてきました。特にDNA損傷による核内情報伝達系の活性化には、毛細血管拡張性運動失調症(ataxia-telangiectasia)の原因遺伝子産物であるATM(AT mutated)タンパク質のリン酸化が引き金となっていることがわかっています。 また、ATMのリン酸化シグナル伝達の下流因子として、DNA修復に関与するとされるヒストンH2AXや53BP1などの因子が同定されています。放射線によって活性化されるリン酸化ATMやこれら因子は、蛍光免疫染色で細胞核内に斑点状の局在を示します。 本報では、放射線ばく露による細胞周期変化と核内情報伝達経路の活性化の相関を解析するために、IN Cell Analyzer 1000を用いたマルチプレックス解析を試みました。
使用した製品機器
試薬
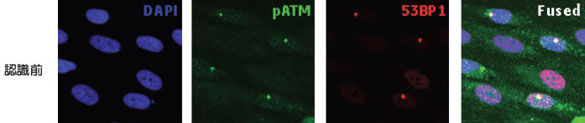
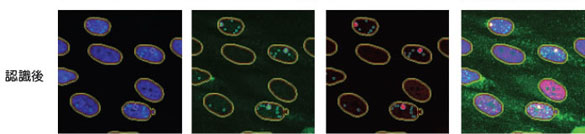
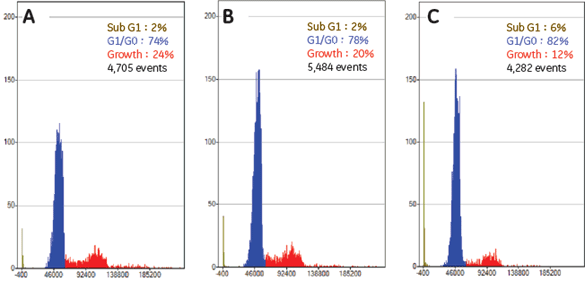
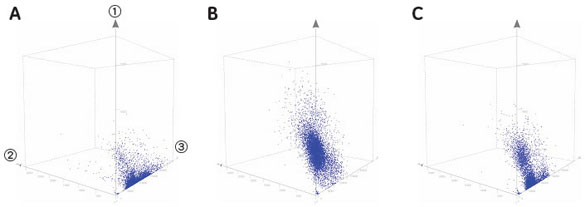
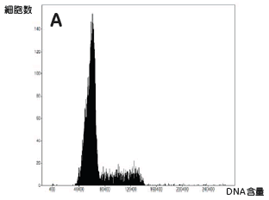
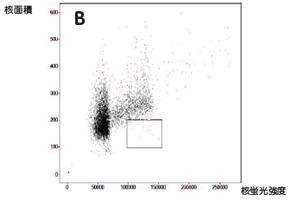
実験操作HE49細胞(ヒト正常2倍体細胞)をカバースリップ上に播種し、培養中に電離放射線をばく露しました。 培養器から出したカバースリップはPBSで洗浄し、4%ホルムアルデヒド/PBS(用事調製)を加えて10分間室温で固定しました。 PBSで洗浄後、0.5% TritonX-100/PBSを加えて、5分間氷上で細胞膜の透過処理を行いました。処理後、PBSで数回洗浄して5%スキムミルク、0.1% Tween-20/TBS(用事調製)で最適濃度に希釈された一次抗体を加えました。抗体処理は100 µlの抗体希釈液をカバースリップに均一にのせ、37℃で2時間反応を行いました。一次抗体反応後、同様に希釈した二次抗体液に終濃度2 µg/mlになるように加え、カバースリップ上で37℃で1時間染色を行いました。二次抗体反応後、PBSで洗浄したカバースリップに10%グリセリン/PBSを滴下し、細胞面が間にくるようスライドガラスに固定しました。最後にスライドガラス周辺の余分な液を慎重に取り除き、カバーガラスの周辺をオイキットで封入しました。 完成したプレパラートはIN Cell Analyzer 1000にて20倍対物レンズを用いて100視野の画像を取り込み、IN Cell Investigatorで細胞画像の数値化を行いました。 それぞれの画像から数値化を行った後、未処理サンプルをコントロールとして放射線ばく露によるATMのリン酸化や、53BP1の局在化を調べました。 結果IN Cell Analyzerで取得した蛍光イメージ(図1)より各解析を行いました。 DAPI蛍光イメージをもとにした核DNA含量の数値化解析の結果、24時間の放射線ばく露により増殖期-分裂期の細胞が減少し、小核が誘発されました(図2C)。また放射線DNA損傷に関連したタンパク質の核内蛍光強度を数値化することにより、ばく露1時間でATMのリン酸化、および53BP1の核局在が誘導されました(図3B)。一方24時間後にはATMタンパク質のリン酸化レベル、および53BP1の核移行が一部細胞では活性化しているものの、多くは正常レベルに抑制されていることがわかりました(図3C)。
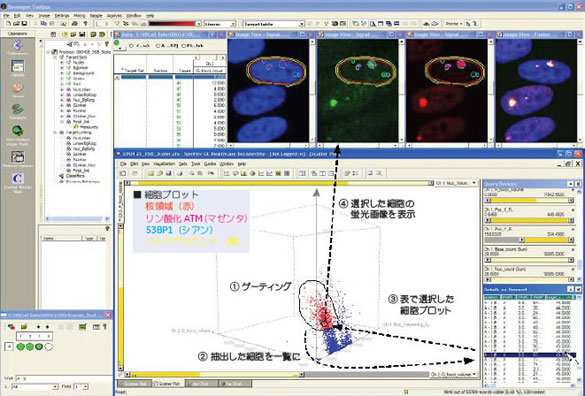
IN Cell Investigatorによる解析の利点IN Cell Investigatorソフトウェアでは、これら細胞画像の数値化と、数値結果を可視化する機能を備えているとともに、個々の細胞レベルでの数値結果と画像をインタラクティブに検証することが可能です。これにより特定の細胞周期にある細胞群について、各々の細胞イメージを呼び出すことができ、さらにリン酸化ATM やその他のシグナル分子の活性化状態を調べることが可能です。
まとめ今回の実験ではIN Cell Analyzer 1000によるイメージングサイトメトリーにより、放射線ばく露による細胞周期変化と核内シグナル分子の活性化の2点を総合的に評価することができました。 IN Cell Investigatorソフトウェアによる解析では、サイトメトリーから得られるプロットデータと蛍光染色画像および数値データがリンクされているため、実際に細胞内で起こっている現象を確認しながら解析をすすめることができます。 このように、IN Cell Analyzerでは形態変化や細胞内局在と組み合せた幅広いサイトメトリーに応用できることが示されました。 ■ サンプルデータご提供長崎大学大学院 医歯薬学総合研究科 お問合せフォーム※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。 お問い合わせありがとうございます。 |
||
© 2024 Cytiva