|
|||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
|||||||||||||||||||||
|
Location:Home > 実験手法別製品・技術情報 > セルラーサイエンス |
|||||||||||||||||||||
抗体ライブラリー評価におけるイメージングサイトメーターIN Cell Analyzer 6000 の活用はじめに今日では抗体ライブラリーの評価は一般的にCell ELISAによるスクリーニングとフローサイトメーターによる結合能の確認を組合せて行われています。フローサイトメーターでの解析には相当量の発現細胞を必要とするため、安定した結果を得るには抗原を安定に高発現したStable cell lineの使用が望ましいとされています。ただし、Stable cell lineの樹立には数か月を要するため、Transient cell lineで評価できる評価系の構築が期待されています。 そこで、レーザーによる励起とsCMOSカメラによって高S/N比で共焦点細胞画像の取得が可能なイメージングサイトメーター、IN Cell Analyzer 6000を使用し、Transient celllineの系での抗体ライブラリーの評価を行いました。その結果Transient cell lineの系でも評価できたうえ、画像から抗体の非特異吸着のシグナルを除くことができ、正確な抗体ライブラリーの評価方法としての可能性が見いだせました。
実験内容使用した製品
プレート
サンプル細胞: 2%パラホルムアルデヒドで固定したCHO(チャイニーズハムスター卵巣)細胞系の細胞-A、細胞-B、細胞-C と親株。細胞A/B/Cは、それぞれGタンパク質共役型レセプター(GPCR)A/B/C を安定に高発現させた細胞。 抗体
* Anti-A1 およびAnti-A2 はそれぞれGPCR-A に特異的な抗体。Negative ControlはB型肝炎ウィルスの表面タンパク質に対する抗体でほ乳動物細胞には交差しない。 免疫染色保存溶液除去後、ブロッキングbuffer を100 μl加え、室温で30 分間静置しました。ブロッキングbufferを除いた後、0.03、0.3、3 μg/mlの一次抗体液を50 μlずつ添加し、室温で1時間インキュベートしました。氷冷したPBS(-)を250 μlずつ添加と除去を4回繰り返して洗浄を行いました。洗浄後、二次抗体溶液(二次抗体希釈buffer で抗体を200 倍希釈したもの)を50 μlずつ添加し、室温で1 時間インキュベートしました。更に氷冷したPBS(-) を250 μlずつ添加と除去を4 回繰り返して洗浄を行い、最後にPBS(-)を100 μlずつ添加しました。核染色はHoechst™ 33342により行いました。 画像取得と解析対物レンズは20x NA0.45を選択してIN Cell Analyzer 6000のConfocalモードとWidefield(Open Aperture)モードの2種類モードで撮影を行い、撮影条件の検討も行いました。選択したフィルタと撮影時間を表1に示します。画像はIN Cell Developer Toolboxソフトウェアを用いて解析しました。 表1 IN Cell Analyzer 6000の撮影条件
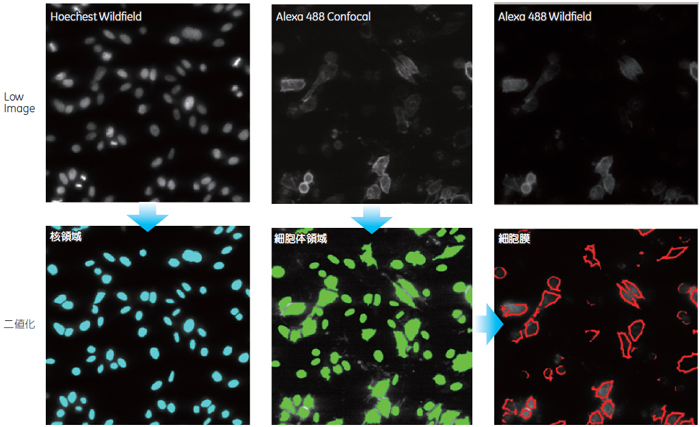
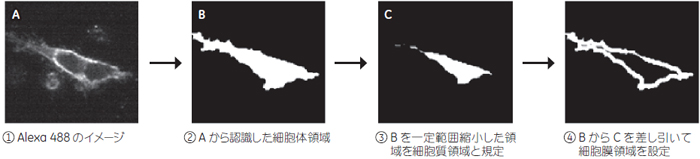
結果と考察1.ターゲット認識Hoechst™染色イメージから核領域、Alexa 488染色イメージから細胞体領域を認識しました。また細胞体領域の外縁を細胞膜領域としました(図1)。まずAlexa 488イメージで免疫染色された領域およびその内側をGPCR-A発現細胞の細胞体領域と定義しました。次にこの細胞体領域を一定のピクセル数縮小した領域を細胞質領域としました。縮小する範囲は、細胞膜に明確な染色パターンが見られる細胞のイメージを参考に規定しました。最終的に細胞体領域から細胞質領域を除いた領域を除いた領域を細胞膜領域としました(図2)。
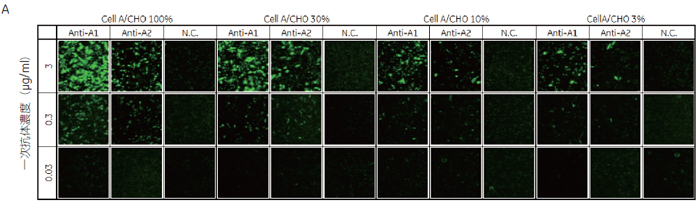
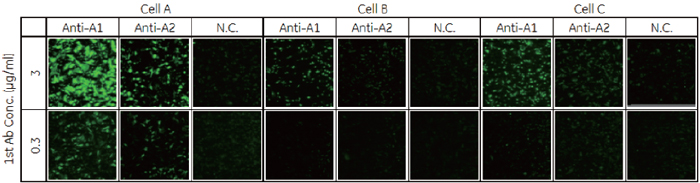
2. スクリーニングに必要な一次抗体濃度と発現細胞の割合の評価GPCR-A を安定発現させた細胞A を用いてIN Cell Analyzer 6000の検出感度の評価を行いました。細胞株A と親株のCHO細胞を、細胞Aの割合が100、30、10、3%となるように混合して播種しました。一次抗体Anti-A1、Anti-A2、NC(ネガティブコントロール)をそれぞれ3 ~ 0.03 μg/mlの濃度で添加しました。
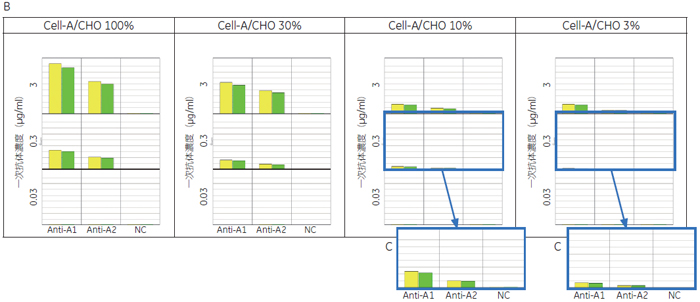
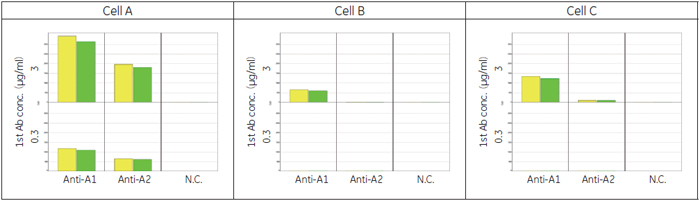
細胞膜領域のAlexa 488蛍光量を算出したところ、細胞Aで安定的に発現するターゲットに対する抗体(Anti-A1、Anti-A2)の抗体濃度依存的なシグナルが検出されました( 図3-B)。抗体ライブラリーのスクリーニングで添加する抗体濃度3 μg/ml もしくは0.3 μg/mlでネガティブコントロールに比べ高いシグナルが得られ、IN Cell Analyzer 6000 が抗体ライブラリーの評価に使用できることが確認されました。 また細胞Aの割合を減じた条件でも、抗体濃度3 μg/mlもしくは0.3 μg/mlでコントロールに比べ高いシグナルが得られました(図3-C)。このことからIN Cell Analyzer 6000ではターゲットタンパク質を発現した細胞が少なくても検出が可能であり、Transient cell lineでも抗体ライブラリーの評価を行える可能性が示唆されました。 3. ターゲットタンパク質の局在評価による陽性/ 偽陽性の分離データの信憑性を確認するため、GPCR-Aを発現していない細胞B、細胞Cに対してAnti-A抗体を添加し評価しました。抗体濃度3 μg/mlの抗体Anti-A1では、GPCR-Aを発現していない細胞Bと細胞Cでもシグナルが検出されました( 図4)。
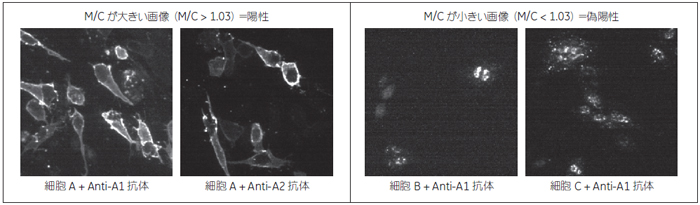
これらのウェルのイメージを確認すると、細胞膜に発現するターゲットに対してではなく細胞体全体が均一に染色されている、細胞膜よりも核領域で強く染色されるなど、非特異的な結合が見られました。このような非特異的結合に由来したシグナルを除くため、細胞膜領域と細胞質領域の蛍光強度を数値化し、細胞毎に細胞膜の蛍光強度/ 細胞質の蛍光強度の比 (M/C)を算出しました。するとシグナルの膜局在が見られる細胞は、局在が見られない細胞に比べてM/C 値が大きく、この数値がシグナルの細胞膜局在を反映していることが分かりました(図5)。
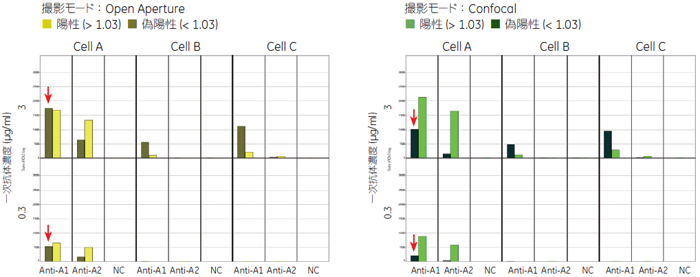
コントロールウェルの結果からM/C が1.03 よりも大きい細胞を抗GPCR 抗体が特異的に結合した細胞(陽性)、M/Cが1.03よりも小さい細胞を非特異的に結合した細胞(偽陽性)として、それぞれの細胞に由来する蛍光量を求めました(図6)。
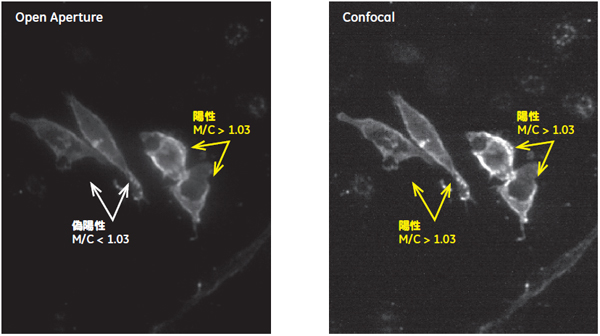
細胞Bと細胞Cで見られたシグナルはほとんどが、抗体が非特異的に結合した細胞(偽陽性)に由来したシグナルとして分離することができました。細胞Aの結果を比較すると、 Confocalモードの方がシグナル全体に対して陽性シグナルの占める割合がOpen Apertureモードのよりも高くなっています(図6)。個々の細胞画像を確認するとConfocalモードで撮影することにより焦点以外の蛍光が排除され、結果としてより明確なシグナル局在が観察されました(図8)。
結論IN Cell Analyzer 6000は、現行のCell ELISA/フローサイトメーターに代わる手法として使用できることが確認されました(図3)。フローサイトメーターでは困難な、発現細胞数が少ないサンプルでも使用できる可能性が示されました。またConfocalイメージで細胞内のシグナル局在を数値化することで、非特異的結合に由来するシグナルの影響を低減して特異的染色を明確に区別できました。特に細胞膜上の抗原をターゲットとした場合、細胞を剥離する必要がないイメージングサイトメーターは有用であるといえます。
データご提供東京大学 先端科学技術研究センター 分子生物医学 お問合せフォーム※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。 お問い合わせありがとうございます。 |
|||||||||||||||||||||
© 2024 Cytiva