
|
||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
||||||||||||||||||||||||||
|
Location:Home > テクニカル情報配信サービス > バイオダイレクトメール > バイオ実験の原理と方法 |
||||||||||||||||||||||||||
バイオダイレクトメール vol.24 Technical Tips
|
||||||||||||||||||||||||||
| サンプル量が少ない場合 | 10,000×gで15分間遠心 |
| タンパク質がフィルターに吸着する場合 | |
| 細胞破砕液 | 40,000~50,000×gで30分間 |
ろ過
微粒子はろ過により取り除きます。タンパク質の吸着の少ないメンブレンフィルター(セルロースアセテートあるいはPVDF製)を使用します。フィルターのポアサイズはその後のクロマトグラフィーで用いる担体の粒子径によって決定します。また、血清サンプルの場合は遠心後にグラスウールまたはフィルターでろ過します。
| フィルターのポアサイズ | 担体の粒子径 |
|---|---|
| 1 μm | 90 μm以上 |
| 0.45 μm | 34 μm |
| 0.22 μm | 3、10、15 μm、あるいは非常に透明なサンプルや無菌ろ過が必要な場合 |
その他のサンプル調製のポイント
サンプルバッファーの組成
基本的にゲルろ過ではサンプルバッファーのpHやイオン強度、組成によって分離能が変わることはありません。サンプルタンパク質および担体が安定するバッファーを使用します。
サンプル濃度
ゲルろ過ではサンプル濃度によって分離能が左右されることはありません(図1)。ただし、サンプルを濃縮するなどして粘性が高くなった場合には分離のピークが広がったり歪んだりするため注意が必要です(図2)。また、タンパク質が完全に溶解していることが重要です。
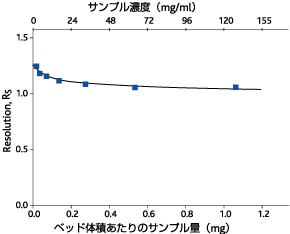
図1. 濃度と分離能の関係
transferrinとIgGを等量ずつ含む溶液を準備し濃度を変えてゲルろ過を行いました。濃度が変化しても分離能(Rs)はあまり変化しないことが分かります。
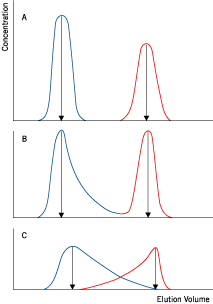
図2. 粘度と分離能の関係
デキストランを加えサンプルの粘度のみを変えた溶液(粘度:A<B<C)を準備し、ゲルろ過を行いました。粘度が上がるにつれ分離が悪くなることが分かります。
サンプル液量
ゲルろ過において、サンプル量は分離能を左右するパラメーターになります。カラム体積に対してサンプル液量の割合が低いほど分離能が向上します(図3)。脱塩・グループ分画ではカラム体積の30%前後、分子量分画の場合は0.5~4 %をサンプル液量の目安とします。
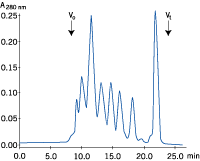
| a) サンプル液量:25 μl | b) サンプル液量:1,000 μl |
|---|---|
 |
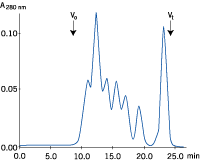 |
図3. サンプル液量と分離能の関係
サンプル液量のみを変えてゲルろ過を行いました(それぞれの溶液には等量のタンパク質が含まれています)。サンプル液量が増加すると分離能が悪くなることが分かります。
※次回は『クロマトグラフィー後の注意点』の予定です。
| ゲルろ過クロマトグラフィーについてより詳しい情報はこちら | |
| Chromatographyのインターナショナルサイトはこちら | |
| ゲルろ過の原理について(Technical Tips vol.23) はこちら | |
| クロマトグラムの見方(Technical Tips vol.25) はこちら |
お問合せフォーム
※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。
お問い合わせありがとうございます。
後ほど担当者よりご連絡させていただきます。
© 2026 Cytiva
