イオン交換クロマトグラフィーを使いこなそう (1)
イオン交換クロマトグラフィーの基本原理
 生体分子はそれぞれ固有の特性を持っており、さまざまな性質の違いを利用することで分離・精製することができます。
生体分子はそれぞれ固有の特性を持っており、さまざまな性質の違いを利用することで分離・精製することができます。
イオン交換クロマトグラフィーとは、このうち電荷の違いを利用して生体分子を分離する実験手法です。英語では「Ion Exchange Chromatography」と記載します。略してIEXと表記することもあります。
1960年代に確立され、微量の精製や分析からキログラム単位のプロセススケールの精製まで、サンプルを高い分離能(例えばたった1つの荷電アミノ酸の違い)で分画可能なため、タンパク質、ペプチド、核酸など電荷を持つ生体分子を精製する方法として最も普及しています。
ここでは、このイオン交換クロマトグラフィーの基本原理から応用までを6回にわたってご紹介していきます。
生体分子を電荷で分ける ~ 有効表面電荷とpHの相関性
生体分子の電荷特性は分子全体の電荷や電荷密度、表面電荷の分布のしかた、溶液のpHなどさまざまな要因によって決定されます。
たとえばタンパク質の場合は、弱酸性や弱塩基性など多種類のイオン性のアミノ酸を含み、正の電荷と負の電荷の両方を分子表面に持っています。この電荷の総和を有効表面電荷と呼び、アミノ酸の荷電状態がpHによって変化するため、タンパク質分子の有効表面電荷も溶液のpHに依存して正や負へ変化します。
イオン交換クロマトグラフィーは、このような生体分子の荷電状態(有効表面電荷)のpHによる変化を利用し、反対の電荷を有する担体と可逆的に結合・溶出させて回収する手法です。
ポイントは、有効表面電荷とpHの相関性(滴定曲線で表すことができます)が生体分子ごとに異なる点にあります。このため、あるpHでは同様に担体に結合して区別できない分子群から、選択的なバッファーの交換とpHのコントロールによって、特定の分子だけを溶出させることが可能となります。
タンパク質の場合は、有効表面電荷がゼロになる等電点(pI)を境に、正・負の荷電状態が逆転します<図1>。等電点より塩基性側のpHでは負に荷電するので、正に荷電した担体(陰イオン交換体)と結合します。対して、等電点より酸性側のpHでは正に荷電し、負に荷電した担対(陽イオン交換体)と結合します。等電点(pI)と等しいpH条件では有効表面電荷がゼロになるため、担体とは結合しません。
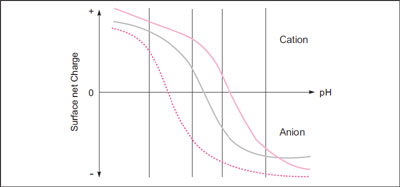
図.1 タンパク質の有効表面電荷とpH の相関を示した滴定曲線の模式図
(有効表面電荷の値が0になるpHが等電点:pI)
このイオン交換基との可逆的な相互作用の他にも、主にファンデルワールス力や非極性相互作用により結合する可能性がありますが、その影響はイオン結合に比べればごく弱いものであるため、有効表面電荷をコントロールするだけでイオン交換クロマトグラフィーによる精製が成り立つのです。
イオン交換クロマトグラフィーによる分離ステップ
イオン交換クロマトグラフィーによる分離は次のようなステップで構成されています。
- ベッドの作成(担体のカラムへの充填・バッファーによる平衡化)
- サンプル添加
- 溶出
- カラム使用後の洗浄
以下に、それぞれの分離工程について、クロマトグラムとあわせて解説します。
■ ベッドの作製
イオン交換担体は、正または負に荷電したイオン交換基を持つ粒子状の担体です。普通は、内部表面積が広くなるように多孔性の担体を使用します。この担体をカラムに充填して、ベッドを作成します。その後、ベッドをバッファーで平衡化し、担体内部の微細孔(ポア)と粒子間の隙間をバッファーで満たします。
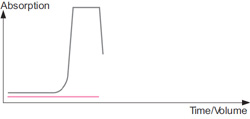
 ベッド作成時のクロマトグラム : イオン交換担体を開始バッファーにて平衡化します。
ベッド作成時のクロマトグラム : イオン交換担体を開始バッファーにて平衡化します。
■ サンプル添加
サンプルを添加した時に、目的タンパク質が確実に担体に結合し、それ以外の夾雑物はできるかぎり結合しないように、平衡化バッファーのpHとイオン強度を選定します。担体に結合するタンパク質はカラム上で効果的に濃縮されますが、そのバッファーのpH環境で担体に結合しないタンパク質は、バッファーと同じ流速でカラムを素通りします。 サンプルの添加中または添加後に、添加量に依存して素通り溶出を行います。
最も効果的に高分離分画あるいはグループ分画を達成し、サンプル添加量を最大限に増やすためには、サンプルの状態がきわめて重要な要因になります。サンプルのバッファーと、カラムを平衡化しているバッファーの成分に大きな違いがあると、洗浄後にも残存する微量の成分が溶出に影響を与える可能性がぬぐえません。そのため、サンプルバッファーが開始バッファーと同じ状態であることが理想的です。 サンプルを全量添加し、結合しないタンパク質がすべてカラムを素通りするまで洗浄したら(UV値がベースライン値に戻る)、結合したタンパク質が溶出するように条件を変えます。
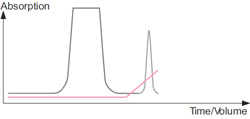
サンプル添加時のクロマトグラム : イオン交換担体と逆の電荷をもつタンパク質が担体に結合し、カラム内で濃縮されます。非荷電のタンパク質や担体と同じ電荷をもつタンパク質は、サンプル添加中またはその後に溶出されます。
■ 溶出
多くの場合、バッファーのイオン強度(塩濃度)を高めるか、あるいはpHを変えて溶出します。イオン強度を高めると、塩イオン(通常Na+かCl-)と担体に結合した成分が担体表面の電荷と拮抗して結合成分が溶離し始め、カラム内を移動します。イオン強度が高くなるにつれて、そのpHで有効表面電荷のもっとも少ないタンパク質から溶出してきます。そのpHで有効表面電荷のもっとも高いタンパク質は非常に強く結合しているため、最後に溶出します。つまり、タンパク質の有効表面電荷が高いほど、溶出に必要なイオン強度が高いということになります。イオン強度の勾配を変えると、タンパク質の溶出パターンは変わります。
溶出時のクロマトグラム1 : イオン強度の上昇(グラジエントを利用)により、カラムに結合していたタンパク質とバッファーに含まれるイオンとの拮抗が生じ、タンパク質が溶出されます。
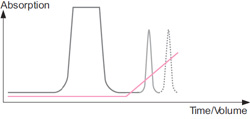
溶出時のクロマトグラム2 : イオン強度の上昇に伴い、より強い電荷をもつ(担体により強く結合している)タンパク質が溶出されます。
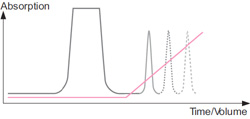
溶出時のクロマトグラム3 : 電荷が強くなる順に、クロマトグラムのピークが形成されていきます。
■ カラム使用後の洗浄
洗浄段階では、非常に高いイオン強度のバッファーを使って強固に結合したタンパク質を取り除きます(カラムの洗浄方法については、イオン交換クロマトグラフィーをつかいこなそう(5)でも詳述しています)。洗浄したカラムは次のサンプルを添加する前に、開始バッファーで平衡化しておきます。目的タンパク質を素通りさせ、夾雑物をできるかぎり多くカラムに結合させる条件を選択して夾雑物を除去することもできます。
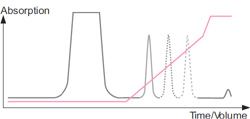
洗浄時のクロマトグラム : 再平衡化前に、最も塩高濃度のバッファーで洗浄し、カラム内に残存するタンパク質を除去します。

イオン交換クロマトグラフィーを使いこなそう
- イオン交換クロマトグラフィーの基本原理
- 分離能に関わる要因
- イオン交換担体(レジン)の違い
- 効果的な分離のための操作ポイント(1)
- 効果的な分離のための操作ポイント(2)
- ~応用編~イオン交換クロマトグラフィーを取り入れた三段階精製



 生体分子はそれぞれ固有の特性を持っており、さまざまな性質の違いを利用することで分離・精製することができます。
生体分子はそれぞれ固有の特性を持っており、さまざまな性質の違いを利用することで分離・精製することができます。





