
|
||
|---|---|---|
|
|
||
|
Location:Home > テクニカル情報配信サービス > バイオダイレクトメール > バイオ実験の原理と方法 |
||
抗体精製をマスターしよう (7)モノクローナルIgGの精製プロトコール
今回は、モノクローナルIgGの精製についてご紹介します。第6回でご紹介した「ポリクローナルIgG の精製プロトコール」と同様に、Protein G/A を用いたアフィニティークロマトグラフィー精製が基本です。今回はそれに加えて、不安定な抗体を精製する際に有用であるイオン交換クロマトグラフィーを用いた精製プロトコールと、精製例についても解説いたします。
大部分のモノクローナルIgG は、アフィニティー精製でOKモノクローナルIgG 精製にはProtein G が最適ポリクローナル抗体の精製時と同様に、リガンドについて考えておきましょう。 リガンドの選択マウスで作製されるモノクローナルIgG は、腹水またはハイブリドーマ細胞培養上清を材料として精製します。マウス由来のモノクローナルIgG は、Protein A よりもProtein G に強い親和性を示すため、精製に用いるアフィニティー担体としてはProtein G をお奨めします。 他の動物種の場合は、第1回でご紹介した「図6 代表的な抗体クラスの生物学的性質」を参考にリガンドを選択してください。 結合が弱い抗体、酸に不安定な抗体の場合にはイオン交換クロマトグラフィーや疎水性相互作用クロマトグラフィーで精製します。 それでは、具体的なモノクローナルIgG 精製のプロトコールを確認しましょう。 HiTrap™ Protein Gを用いたアフィニティー精製プロトコール準備するバッファー
サンプルの調製HiTrap™ Protein G 1 ml カラムへの添加腹水量の計算腹水中には1~15 mg/ml のIgG が含まれています。初回の精製では、5~10 mg IgG を目安としてサンプルを準備し、カラムを選択してください。カラムへの最大添加量については、下記リンク先をご参照ください。 (下記はポリクローナル抗体精製時と同様) サンプル液量の増加は精製には影響しません。精製サンプル量が少ない場合には、結合バッファーで希釈(5~10 倍)してください。 HiTrap™ Protein G と用いた精製操作HiTrap™ Protein G を用いた精製操作は、ポリクローナル抗体精製時と同じです。リンク先をご参照ください。 モノクローナルIgG のアフィニティークロマトグラフィー精製例原料となる腹水やハイブリドーマ細胞培養上清は、IgG 以外のタンパク質をほとんど含みません。そのためProtein A やProtein G をリガンドとしたアフィニティークロマトグラフィーにより、ワンステップで高純度な抗体を精製することができます。また、IgG は濃縮して溶出されることからハイブリドーマ細胞培養上清のように大量の原料からモノクローナル抗体を精製する場合において、最も好まれている精製手法の1 つです。 ポリクローナルIgG の精製と同様に、動物種やサブクラスによってProtein A とProtein G に対する親和性が異なりますので担体を使い分けます。抗体とProtein A またはProtein G の親和性の詳細は、第1回でご紹介した「図6 代表的な抗体クラスの生物学的性質」 をご参照ください。 マウス モノクローナルIgG10 ml のマウスハイブリドーマ細胞培養上清から抗EPO(EPO:Erythropoietin)モノクローナルIgG2b を、MAbTrap™ Kitで精製した例を紹介します。精製はキットに付属のシリンジを使ったマニュアル操作とペリスタルティックポンプによる操作の両方で行いました。方法によって回収量に差は認められないことがわかります。 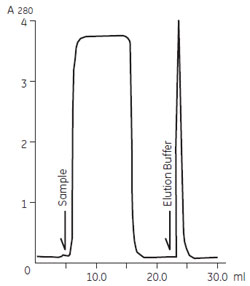
図1 マウス モノクローナルIgG2b の精製(ポンプ使用) 試験管には前もって数滴の中和バッファーを入れておき、すぐに溶出画分の中和を行いました。
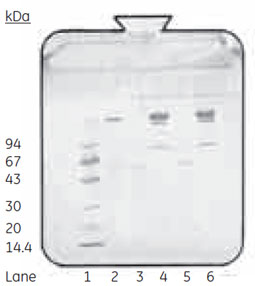
図2 各画分のSDS-PAGE分析(非還元)
【精製の流れ】 5 ml の結合バッファーを送液後、サンプルを添加しました。 ヒト化 モノクローナルIgG4血清を含むハイブリドーマ細胞培養上清(30 ml)から11.2 mg のモノクローナルIgG4 をHiTrap™ rProtein A で精製した例を紹介します。 リガンドの rProtein A は、天然型Protein A のalbumin 結合領域を遺伝子工学的に除去して大腸菌で生産した組換え体タンパク質です。血清を含むハイブリドーマ細胞培養上清や抗血清からの抗体精製で威力を発揮します。SDS-PAGE の結果、サンプル中に含まれるalbumin は素通りし、溶出画分のIgG4 の純度は95 % 以上(SDS-PAGE)であることがわかりました。回収率は93 % でした。 ※サンプルはDr. J. Bonnerjea, LONZA Biologics plc, UK より寄贈いただきました 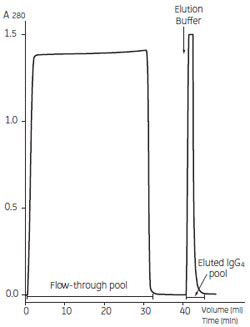
図3 ヒト化モノクローナルIgG4 の精製 サンプルを添加後、10 ml の結合バッファーで洗浄、5 ml の溶出バッファーで溶出しました。
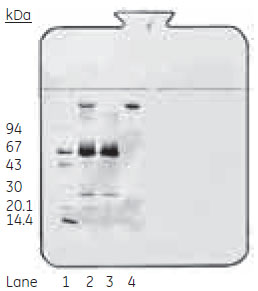
図4 溶出画分のSDS-PAGE分析(非還元)
ラット モノクローナルIgG の精製ラットのIgG はProtein A には結合しないので、Protein G で精製します。10 ml のラット ハイブリドーマ細胞培養上清から抗CD4 モノクローナルIgG2b をProtein G Sepharose™ 4FF 担体で精製しました。 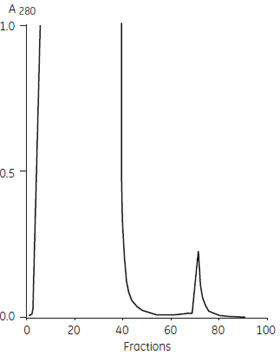
図5 ラット モノクローナルIgG の精製
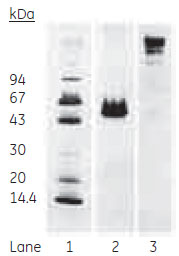
図6 溶出画分のSDS-PAGE分析(非還元)
酸性条件に不安定なモノクローナルIgG の精製イオン交換クロマトグラフィーを用いたモノクローナルIgG 精製プロトコールProtein G やProtein A を使用した抗体のアフィニティー精製では、溶出に酸性バッファーを使用するため抗体が失活する危険性があります。このような酸に不安定な抗体の場合には、中性付近のバッファーで精製するイオン交換クロマトグラフィーが適しています。 ここでは、HiTrap™ イオン交換 1 ml カラムの場合のプロトコールをご紹介します。5 ml カラムを使用する場合は、流速およびバッファー使用量を5 倍にしてください。 準備するバッファー陰イオン交換体(Q, DEAE)
陽イオン交換体(S, SP, CM)
サンプルの調製イオン交換担体はProtein A やProtein G よりも大きな吸着容量があります。大量に添加すると溶出時の抗体濃度が高くなり、凝集することがあるため、カラムへの添加量は10 mg程度までとします。 サンプル中の不純物や不溶物を除去し、HiTrap™ Desalting カラムで結合バッファーに交換します。サンプル量が10 ml を超えるような場合は、サンプルのpH を上記結合バッファーpH に合わせてください。
HiTrap™ イオン交換カラムを用いた精製操作
イオン交換クロマトグラフィーによるモノクローナルIgG の精製例Protein A やProtein G でのアフィニティークロマトグラフィー溶出時の酸性条件で失活する不安定な抗体の場合には、精製条件が温和なイオン交換クロマトグラフィーで精製を行います。引き続いてゲルろ過クロマトグラフィーにより、分子量の差でIgG を精製します。陽イオン交換体と陰イオン交換体のどちらが適当であるかは、予備実験によって決定します。 陽イオン交換クロマトグラフィーによる精製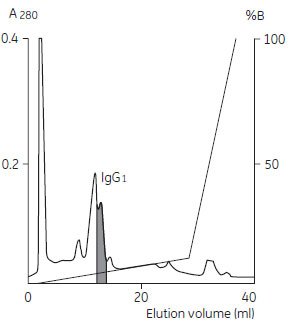 抗体の精製では、陰イオン交換クロマトグラフィーよりも陽イオン交換クロマトグラフィーが広く利用されています。 その理由は、マウスIgG の等電点はpI 5.0 ~ 9.5 で、主要夾雑タンパク質の等電点(Albumin やTransferrin はpI 4.7 ~ 5.0)よりも塩基性側にあるからです。陽イオン交換クロマトグラフィーでは、大部分の不純物はカラムを素通りし、結合した抗体は塩濃度グラジエントでさらに精製することができます。 (左)図7 陽イオン交換クロマトグラフィーによる精製 サンプルの溶出はpH 6.0, 5.0, 4.0 の3 種類の溶出バッファーを順番に送液して行いました。それぞれの溶出バッファーは、ピークが下がって安定するまで送液しました。 (データ提供:Dr. Paul Steffens, Pharmacia LKB GmbH, Freiburg, Germany)
サンプルの大部分はカラムを素通りするため、陽イオン交換カラムは洗浄を頻繁に行わなくても寿命を保つことが可能です。 陰イオン交換クロマトグラフィーによる精製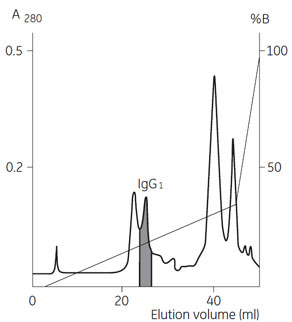 一方、陰イオン交換クロマトグラフィーでは、夾雑タンパク質もカラムに強く結合するため、抗体との分離が難しくなることもあります。 この例では、塩濃度のほかにpH グラジエントを組み合せることで、分離能を改善しています。 (左)図8 陰イオン交換クロマトグラフィーによる精製 (データ提供:Dr. Paul Steffens, Pharmacia LKB GmbH, Freiburg, Germany)
* 塩濃度とpH グラジエントを組み合せて溶出しました 腹水には抗体のほかに血液凝固系のタンパク質も含まれ、カラム目詰まりの原因となります。あらかじめカプリル酸沈殿などにより清澄化して沈殿を生じるタンパク質を除去することをおすすめします(第4回を参照)。 カラムの寿命を延ばすために、カラム洗浄も頻繁に行ってください。汚れの沈着を防ぐために、精製後すぐに洗浄してください。 Protein G/A を用いたアフィニティークロマトグラフィーと、イオン交換クロマトグラフィーによるモノクローナルIgG の精製法についてご紹介しました。 モノクローナル抗体の作成過程で含まれるIgG 以外のタンパク質は非常に少ないため、ポリクローナルIgG の精製時にも増してアフィニティークロマトグラフィーが威力を発揮します。精製手法の第一選択は、アフィニティークロマトグラフィーで良いでしょう。 アフィニティー精製溶出時の酸性条件で不安定なIgG抗体のみ、他の手法を選択します。その際には、陽イオン交換クロマトグラフィーからお試しいただくのがよいでしょう。 次回は、さらに高純度にモノクローナルIgG を精製したい場合に、どのようなステップで行えばよいかについてご紹介します。 お問合せフォーム※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。 お問い合わせありがとうございます。 |
||
© 2026 Cytiva
 前回に引き続き、抗体精製プロトコールをご紹介します。
前回に引き続き、抗体精製プロトコールをご紹介します。