|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Location:Home > テクニカル情報配信サービス > Pharma Mail |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
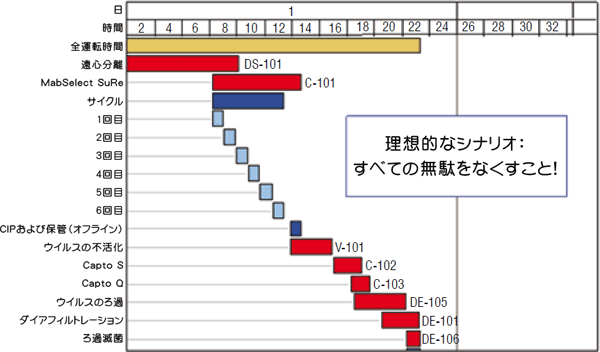
 卓越したプロセスと製品の安全性をもたらすReady-To-UseテクノロジーEric Grund、Cytiva(インド)、FastTrakバイオ医薬品サービス部長 細胞培養、回収やダウンストリーム精製などのバイオ医薬品製造プロセスにおいて、プロセス堅牢性と製品安全性の保証が真剣に考えられるようになるにつれ、これらのプロセスの重要性が急速に高まっています。本稿では、バイオ医薬品製造において重要性が高まりつつあるLEANのコンセプトとReady-To-Useテクノロジーについてご紹介します。 1982年にイーライリリー社が初めて遺伝子工学により製造したインスリンを導入して以来、バイオ医薬品は大きな成功を収めており、ホルモン、ワクチン、インターフェロンが製造されています。また、最近のヒト化モノクローナル抗体(Mab)製造の成功により、市販化されたバイオ医薬品は更に数を増しました。伝統的な製薬会社が、副作用や長期にわたる開発期間と奮闘しながら創薬研究や新規化学物質を上市するための研究に力を注ぎ続ける中、バイオ医薬品に携わる人々は、ヘルスケアに関する難題は高い確率で解決される一方で、ウイルス汚染、不純物、免疫応答の可能性などのリスクといった別の難題に直面しています。 バイオシミラー医薬品製造における障害特にグローバルな観点から業界を考えると、今日ではバイオ医薬品のパイプラインに「バイオシミラー医薬品」の数が増加しています。ヨーロッパではこのカテゴリーで成長ホルモンとエリスロポエチンが承認されていますが、米国では「後発生物製剤(follow-on biologicals)」に関する規制上のアプローチが最終化されていません。多くの理由からバイオ医薬品は魅力的ですが、バイオ医薬品の開発・製造において近道をすることは望ましくありません。宿主細胞の遺伝子操作、細胞培養、回収、ダウンストリーム精製といったプロセスは重要であり、製品安全性の保証について真剣に対処する必要があります。 バイオシミラー医薬品メーカーは、元のタンパク質製剤を開発したメーカーとは異なる製造法やより安価な製造法を利用したり、分析の精度を低下させることを考えてはいけません。バイオシミラー医薬品に対するプロセス堅牢性と安全性の要件は、必ず元のタンパク質製剤と同一でなければなりません。実際にバイオシミラー医薬品メーカーが同等性を証明するための精密な調査を受た後で、元のバイオ医薬品製造に利用されていたものと同じプロセスを利用する方が簡単であると気づく場合もあります。 関連分野である血漿タンパク質が1980年代にウイルス汚染による打撃をどのように受けたかを確認したところ、複雑な生物学的プロセスとキャラクタライゼーションが困難な巨大生体分子には低分子化学物質メーカーが採用可能な手っ取り早い方法が受け入れられないことが明らかになっています。とはいえ、技術は進歩しており、これまでに蓄積された問題および改良への動向に対処すべき時が来ました。 ダウンストリーム精製のボトルネックを克服Mab製造では、ダウンストリーム精製におけるボトルネックが話題になることがよくあります。これは主に、関節リウマチや癌の治療に使用される、大きな成功を収めた製品のために、哺乳動物細胞培養のキャパシティーに対してかなりの投資が行なわれたことが原因です。容量10,000リットルを上回るバイオリアクターの「6基セット」が数多く確立されたのと時を同じくして、アップストリームの技術はMabのタイターが頻繁に1 g/Lを超えるレベルにまで改善されました。この値は最近の15年間で100倍に増加しており、設備設計の時点で認識されていた初期産生レベルでの運転を前提としたダウンストリーム精製プロセスのキャパシティーに対して明らかにかなりのストレスを与えていますが、プラットフォームプロセスで最新のクロマトグラフィー担体を利用することで確実にMabをバイオリアクターバッチあたり約100 kg、年間10,000 kgのレベルで精製することができます。一般的には、6基のバイオリアクターから1ラインのダウンストリーム精製トレインに供給され、培養での高いタイターは短縮されたダウンストリーム精製処理時間とでバランスが保たれています。 図1. 年間1トンおよび10トンのMabを製造するためのダウンストリーム精製シナリオ(6基のバイオリアクターの培養液を1つのダウンストリーム精製トレインで処理)
LEANのようなプロセス改善法を用いると、プロセスのよりよいフローを生み出したり、停止をなくしたり、非生産的な作業(製造キャンペーン間の切替え時間、洗浄工程、装置の準備やプロセス用バッファーの調製など)を減らす方法を見つけることができます。 LEAN用語ではこのような作業を「無駄」と呼びます。「無駄」は簡単になくせますが、使用中の技術には多少の無駄が必要であり、また柔軟性と堅牢性のためにもある程度の無駄が役立ちます。各バイオリアクターからのMabの産生量は非常に高いレベルに達していますが、Mabは10日後(学会で頻繁に報告されるような非常に高いタイターに到達するためには、10日以上かかるのが一般的)にしか回収できない一方、ダウンストリーム精製プロセスは2日で切替え可能です。LEANを採用することにより、この時間は24時間まで短縮可能です。また、非常に高いレベルまで開発されたクロマトグラフィー2段階のみからなる最新のダウンストリーム精製プラットフォームアプローチを採用すれば、この時間をさらに短縮できるでしょう。 どれだけのキャパシティーが今後必要になるかは大きな問題です。実際には機敏性が要求され、特に新規事業を開始したばかりの企業やバイオ医薬品分野での新規事業を開始した企業にはこの傾向が顕著です。先に述べたような年間10,000 Kgを必要とする大型企業はほとんどないでしょう。特定の製品について必要とされる量を予測することは困難です。パイプライン中の多くの製品は同じ適応症に対するものか、全く同じ患者群向けの厳密なバイオシミラー医薬品です。また、バイオ医薬品の薬効の強化や半減期の延長を目的とした開発も行なわれています。テーラーメイド医薬品については、小規模な患者群を対象にした医薬品であるという理論を続けており、いわゆるミニバスター(minibuster)につながっています。市販までの競争では大規模なキャパシティーに投資する以前に、少量の医薬品を治験用に製造するためのスピードが必要です。以上の要素のすべては、操作に必要とされるスケールを拡大するというより、むしろ縮小するものであり、柔軟性とスピードがより求められています。 スピードの意味を考えてみましょう。最初に上市したいという根本的な希望の他にもいくつかの新たな視点があります。たとえば、ワクチン分野で説明すると、インフルエンザの流行に向けてワクチンが準備されますが、ここでは従来のアプローチよりも短期間のスケジュールを要します。
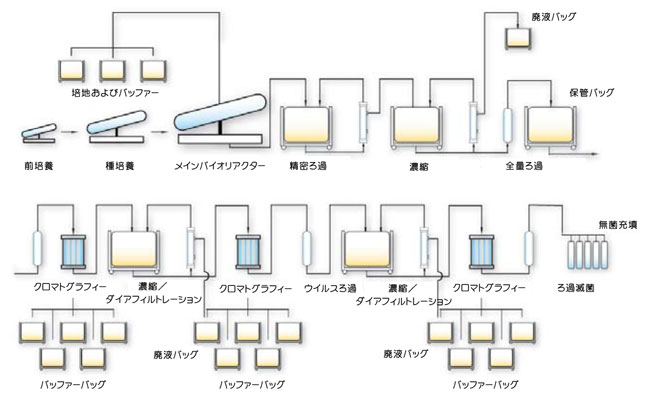
Ready-To-Useテクノロジー卵を使用する現在の技術では株の同定から6~9か月後にワクチンを供給可能ですが、株の同定から3か月以内にワクチンを供給することが合理的な達成目標です。ウイルス様粒子(VLP)の利用は有望なアプローチです。米国を拠点とするNovavax社(Rahul Singhvi社長兼CEO)では昆虫細胞を用いた製造とCytivaのReadyToProcess™蓿製造ラインを組み合わせた製造法をベースとしたアプローチを開発中です。遺伝子工学によるバキュロウイルスベクターとバイオリアクター内での昆虫細胞培養を利用すると、卵を使用する従来の方法よりもVLPを利用する方法によってインフルエンザワクチンをはるかに速く製造することができます。 今日の強い要求によってワクチン業界のスピードと柔軟性が増していますが、これはディスポーザブルバッグ内での細胞培養、速やかな切り換えが可能な配管、すぐに使える(Ready-To-Use)ディスポーザブルフィルターカートリッジと最新の技術革新であるクロマトグラフィー用のReady-to-processプレパック製造用カラムによって実現可能となります。Novavax社はこれらの技術を組み合わせることによってプロジェクト時間を半分に、スタートアップ時のコストを1/3に削減できるものと考えています(ワクチン1億本に関する試算に基づいています)。さらに、潜在的病原菌への作業者の暴露も制限されます。 この数年間では「ディスポーザブル」、「使い捨て」、「すぐに使えて互換性がある」などといった用語の使用に関する話題が増えていますが、実際にそれぞれの用語はかなり異なる品質のシステムや製品を指しています。Ready-To-Useテクノロジーはバイオ医薬品製造に「プラグアンドプレイ(接続すればすぐに使える)」という可能性をもたらします。Ready-To-Useテクノロジーの多くは実際に使い捨てでディスポーザブルですが、廃棄するまでに何度も再使用できるものもあります。しかしながら、Ready-To-Useプラットフォームの鍵は使い捨てであることではなく、スピードと柔軟性です。 Mab分野では標準化と柔軟性が必要です。成功する企業は多くのプロジェクトを並列処理でき、うまくいかないものを打ち切って、うまくいくものに切替えます。ステンレススチールの使用をやめてプラスチックに切替えるというReady-To-Use革命はここでも成功への鍵となっています。ここでも使い捨てであることは本質的な問題ではなく、製造の変更を行なうことのできるスピードと閉鎖系での処理能力、手動操作に関連するリスクを軽減する能力が本質的な問題となります。交叉汚染は主な頭痛のたねではなくなります。LEANの考え方を適用したラインでは洗浄工程がなくなり、多くのバリデーションの課題が減小します。Mabに関しては、バイオリアクターから精製までのすべての単位操作をReady-To-Useのプラスチック部品(バイオリアクター、全量ろ過フィルター、クロスフローフィルター、ミキサー、配管、コネクターおよび2または3段階のクロマトグラフィーステップを含む)に置き換えることができます。
試算では、容量500リットルのプラスチックバッグ式バイオリアクターとタイター5 g/LのMabからバッチあたり2.5 kgのMabを製造できることがわかっています。したがって、このバイオリアクターを「6基セット」にすれば年間400 kgを製造でき、現在市販されている大部分のMab製品の年間必要量に対応できます。このようなセットアップを利用すれば、従来のステンレススチール製バイオリアクターと比較して非常に高い柔軟性が得られ、必要なスペースは小さくなり、少ない先行投資額で済むほか、コミッショニングが迅速化し、運転時間が短くなります。アップストリームプロセスの洗浄と滅菌のステップ(これは典型的な「無駄」)は滅菌と洗浄のバリデーションとともに除かれ、施設にとって利用できる製造時間が増加します。 評価・殺菌済みのプレパックカラムを使用するMabのダウンストリーム精製に目を向けてみると、担体スラリーの調製とカラム充填が不要となり、プロセス内の「無駄」を前もって除けます。装置は一般的なCIPに安定であるため、繰返し使用が好ましいかや、より経済的なオプションについてはユーザーが決定することができます。1サイクルで約600 gのMabを吸着可能なサイズの新型プレパックカラムが提供されています。これは実際には、上述したバイオリアクターからの5サイクルの操作とより小さなカラムを用いた1サイクルのイオン交換による最終的なポリッシングを行えば、2.5 KgのMabを回収できることを意味します。セットアップ面では時間、注射用水(溶液の洗浄に必要)とハードウェア費用をかなり節約できます。これらのReadyToProcess™ソリューションはいずれもスタートアップ時の洗浄を必要としないため、バリデーション試験の負荷もかなり軽減されます。最後に、ReadyToProcess™ソリューションを用いる場合、従来のバイオリアクターとダウンストリーム精製を採用した場合よりも熟練した作業者の人数は少なくて済むといえるでしょう。 これは、バイオ医薬品製造の将来に大規模な専用のステンレススチール工場は必要ないという意味ではありません。切替えと柔軟性の必要性があまりない安定した大規模製造には、経済的に利点があります。ディスポーザブルおよびReady-To-Useソリューションにはサイズの限界があります。ディスポーザブルのプラスチックは機械的強度が劣り、スケールの限界があるため、将来どのような大型ソリューションが開発されたとしても固定配管で接続された施設が必要となります。成功を収めたバイオ医薬品企業は市販までの競争に機敏に対応し、競争に勝った後は費用対効率を高めるために、両方のアプローチを利用するでしょう。 今後の展望現在、バイオ医薬品業界は急速に変化しています。私たちには大きな障害はなく、特にMabはワクチンや特定のオリゴヌクレオチドをベースとする治療法に向けた新たなアプローチ同様、大きな期待が見込めます。業界のグローバル化が進むとともに、アジア諸国からの新規参入は柔軟性のない時代遅れの施設の立ち上げをせず、現在利用可能となった迅速でフレキシブルなアプローチを採用することが可能になりました。現在、アジアのバイオ医薬品企業はアジアで流行している疾患にも対処し、革新的な新規のバイオ医薬品やワクチンを開発することも可能です。 アジアでは経験豊かな人材が不足しているとはいえ、現在この状況は変化しつつあります。また、メーカーは製品を上市するまでに多くの不確実性に直面します。機敏性は勝者と敗者を分ける鍵となります。ディスポーザブルのReady-To-Useシステムの使用は、伝統的にステンレススチール製のシステムを愛用してきた技術者に受け入れられるべき重要な変化です。これは使い捨てであるからではなく、これらがもたらすスピードと柔軟性によって節約できた時間を技術革新や産業の再考案にもっと有効に利用できるからなのです。 参考文献の詳細についてはwww.pharmafocusasia.com/magazine/をご参照ください。 著者Eric Grund博士は約30年間にわたり生体分子精製の分野に従事してきました。現在はインドのバンガロールを拠点とし、CytivaのFastTrakビジネスの責任者として世界中でバイオプロセスアプリケーションをサポートしています。Grund博士はスウェーデン、カナダ、日本、ドイツの勤務経験を持ち、広く国際的な経験があります。最近の10年間はモノクローナル抗体、ワクチン、血漿タンパク質、遺伝子組換えタンパク質の大規模工業スケール精製を中心に研究を行なってきました。 *Eric Grundはその後スウェーデンに移り、マーケティング部でStrategic Customer Relations を担当しています。 お問合せフォーム※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。 お問い合わせありがとうございます。 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
© 2026 Cytiva