Superdex™ 200 Increaseカラムの使用例
パパインで切断したモノクローナル抗体のサイズ排除クロマトグラフィー解析
このアプリケーションノートでは簡易化されたFabフラグメントの調製方法の流れをご紹介します。精製されたモノクローナル抗体(MAb)をパパインで切断後、HiTrap™ MabSelect SuRe™とHiTrap™ Protein Lカラムで精製し、Fabを作製しました。中間精製物と最終精製物の解析は、1本の長さ300 mmあるいは1本の150 mmのSuperdex™ 200 Increaseカラムを用いたsize exclusion chromatography(SEC、またはゲルろ過)によって行いました。Superdex™ 200 Increaseの高分解性が抗体の単量体、凝集体、フラグメントをそれぞれベースラインまでの分離を可能にしました。
イントロダクション
MAbフラグメントは分子量が小さく、インタクトな抗体と比べてin vivo実験での免疫原性が低いため注目されています。
Fabは大腸菌(E. coli)などを宿主として直接的に発現させるか、作製した抗体をパパインで切断することで作製されます。いずれの場合も、Protein AやProtein Lを結合させた担体が充填されているアフィニティークロマトグラフィーを用いて純度の高い最終産物を得ることができます。
この研究では、精製したMAbをパパインで切断してFabを作製しました。作られたFabはHiTrap™ MabSelect SuRe™とHiTrap™ Protein Lカラムを用いて精製しました。
Fabの純度はSuperdex™ 200 Increaseで解析しました(図1)。Superdex™ 200 Increaseは分解能が高くMAbおよびFab, Fc の分離だけではなく、MAbとFabのそれぞれの凝集体とモノマーの分離も可能です。

図1. ÄKTA pure™ クロマトグラフィーシステムを用いてSuperdex™ 200 Increase 10/300 GLカラムによるSEC解析を行いました。
パパイン処理した抗体から抗体フラグメントを調製する方法は古くからありましたが、この研究のようにHiTrap™ MabSelect SuRe™とHiTrap™ Protein Lを用いることでより簡便に調製できるようになります。また、Superdex™ 200 Increaseカラムを用いることで精製工程をより詳細に解析することができます。
Superdex™ 200 Increaseのクロマトグラフィー担体はhigh-flowアガロースをベースマトリックスとし、良好な圧力・流速特性を持ち、粒子径が小さい(平均ビーズサイズ8.6 um)ことが特徴です。
非特異的相互作用が少ないため生体原料が高い収率で得られます。また、粒子径が小さいため、高分解能の分析分離が可能です。
材料と方法
MAbの作製とパパイン処理
Kappa 1軽鎖を含むIgG サブクラス1のヒトモノクローナル抗体をCHO細胞系で発現させ、表1、step 1の条件で精製しました。精製MAbを含む画分を回収し、SEC解析と次のパパイン切断ステップを行いました。
Fabを作るために、パパイン(0.1 mg/mg MAb)で精製MAbを一晩、37℃で処理しました。処理後、パパインの切断反応を阻害するために30分、常温でantipainとインキュベートしました。
Fab精製
MAbをパパインで切断して作られたFabは切断されていない、または切断が不十分なMAbやFcから、表1, Step2にまとめた方法に従い分離しました。SEC解析のために画分を回収しました。
フロースルー画分のFabは表1, Step 3の条件でさらに精製し、SEC解析のためにFabを含む画分を回収しました。

表1. Fabの精製工程
Size exclusionクロマトグラフィー解析
各精製ステップのすべての精製中間物質と最終精製物はÄKTA pure™ クロマトグラフィーシステムに接続したSuperdex™ 200 Increase 10/300 GLとÄKTA™microクロマトグラフィーシステムに接続したSuperdex™ 200 Increase 5/150 GLの2つのカラムを用いて解析しました。すべての解析は10 mMリン酸緩衝液, 2.7 mM KCl, 140 mM NaCl, pH 7.4(PBS)で行いました。
結果と考察
Fabの精製工程を表1に示し、MAb, Fc, Fabおよびパパインの各分子量(Mr)を表2にまとめました。

表2. MAb, FC, Fabおよびパパインの分子量
精製MAbの解析
HiTrap™ MabSelect SuRe™カラムの精製(表1, Step 1)で得られたMAbを含む画分のSEC解析をSuperdex™ 200 Increase 10/300 GLとSuperdex™ 200 Increase 5/150 GLカラムを用いて行いました(データ未記載)。
Fabを含むフロースルーの解析
HiTrap™ MabSelect SuRe™を用いた精製(表1, Step 2)によって得られた フロースルー(図 2A)のFab画分をSuperdex™ 200 IncreaseでSEC解析しました(図 2B, C)。長い300 mmカラムと比べて、短い150 mmカラムは解析に1/4の時間しかかかりません。
HiTrap™ MabSelect™ SuRE の溶出液のSEC解析(図 2A)からわかるように、ごく少量のFabしかカラムに結合しません(SECデータ未記載)。
精製Fabの解析
表1, Step 3のフロースルーに含まれるFabを、さらにHiTrap™ Protein Lカラムで精製し(図 3A)、回収した画分の純度をSECで解析しました(図 3B, C)。
HiTrap™ Protein LカラムのフロースルーをSEC解析したところ、ごく少量のFabとFcしか含まないことがわかりました(SECデータ未記載)。
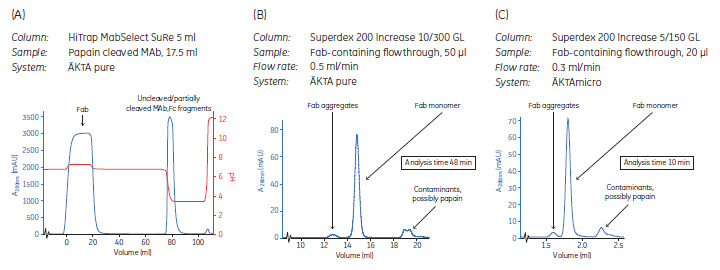
図2. パパイン処理後にHiTrap™ MabSelect SuRe™ 5 mlカラムを用いて切断されていないMAb, 部分的に切断されたMAb, FcからFabを分離しました。フロースルーにはFabとその他不純物が含まれます。溶出画分にはFc、切断されていないMAb、部分的に切断されたMAbが含まれます(A)。Fabを含むフロースルーのSEC解析はSuperdex™ 200 Increase 10/300 GL (B)またはSuperdex™ 200 Increase 5/150 GL(C)を用いて行いました。
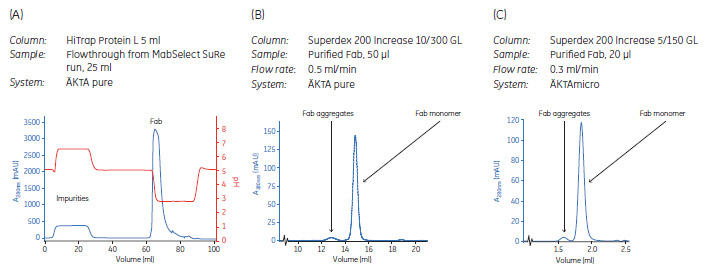
図3. FabをさらにHiTrap™ Protein Lカラムで精製しました。フロースルーには不純物が含まれます。溶出液にはFab が含まれます(A)。精製FabのSEC解析はSuperdex™ 200 Increase 10/300 GL (B)またはSuperdex™ 200 Increase 5/150 GL(C)を用いて行いました。
MAb, Fab解析結果の重ね書き
Superdex™ 200 Increaseは分画範囲(Mr 10.000 to Mr 600,000)が広いため、さまざまな生体分子の分離が可能です。
MAb, Fab, FcのSEC解析結果を重ね書きしてSuperdex™ 200 Increaseの媒体の分離効率を示します(Fcの精製工程はこのアプリケーションノートに含まれません)(図 4)。
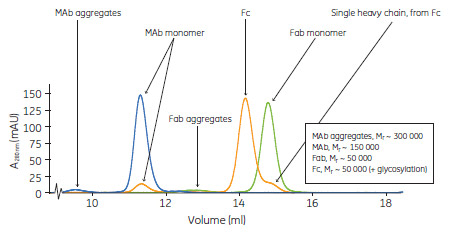
図4. Superdex™ 200 Increaseによる精製MAb(青)、Fab(緑)、Fc(橙、精製情報は未記載)のSEC解析結果のoverlay。比較のためにすべてのカーブはそれぞれの単量体のピークの高さに合わせて正規化されています。
結論
HiTrap™ MabSelect™ Sure とHiTrap™ Protein Lを用いて、MAbのパパイン処理から精製Fabを調製するまでの流れがよりシンプルになりました。
Superdex™ 200 Increaseの高分解性はFabとMAbの単量体と凝集体のベースラインまで分離することができます。
どちらのカラムサイズも解析ツールとして使いやすく、お互いを補完します。
- 高い分解能での高精度な解析が必要な場合:10/300 GLカラム
- 解析時間の短縮が必要な場合:、5/150 GLカラム

