|
||
|---|---|---|
|
|
||
|
Location:Home > テクニカル情報配信サービス > Pharma Mail |
||
ReadyToProcess™製品を使用したダウンストリームにおけるインフルエンザウイルスのスケールアップ精製本稿ではシングルユースのReadyToProcess™技術を用いて、インフルエンザウイルスを精製したケーススタディーをご紹介します。ReadyToProcess™プラットフォームはフレキシブル性に富んだ製造ツールで、ウイルスの取扱いを容易にし、生産性の向上に寄与します。生あるいは弱毒化インフルエンザのモデルシステムとして、A/H1N1/ソロモン諸島株をVero細胞で生産するモデルを使用しました。ダウンストリーム精製のプロセス時間は3日間であり、また、全体のスケールアッププロセスの検討において、インフルエンザウイルスの生産は、ラボ結果で得られた場合と同程度の生産性および純度が得られました。 はじめにワクチン製造業界では、パンデミック発生に迅速に対応するため、フレキシブル性の向上と時間の短縮が技術的な重要な課題となっています(参考文献1,2)。インフルエンザウイルスの場合、ワクチンは伝統的に有精卵を用いて製造し、固定されたスチール製の設備で精製されています。 本稿では、細胞培養で生産されたインフルエンザウイルスのダウンストリームの精製について、シングルユースのReadyToProcess™プラットフォームを使用し培養液10 Lから50 Lへのスケールアップについて記載します。ReadyToProcess™プラットフォームは、フルイドハンドリングにおいてディスポーサブルでスケールアップ可能なソリューションを提供します。シングルユース技術は洗浄や洗浄バリデーションなどの機器の準備時間に必要な時間を減らし、クロスコンタミネーションのリスクと伝統的なワクチン製造方法での幅広いパラメータを最小化できます。 この研究では、Vero細胞をマイクロキャリアー上で成長させ、インフルエンザウイルス(A/H1N1)を感染させました。ダウンストリームのスケールアップ精製プロセスでは、インフルエンザウイルスの生産が、ラボ結果で得られた場合と同程度の生産性および純度が得られました。
材料および方法ラボスケールでの10 L細胞培養からのインフルエンザウイルスのダウンストリーム精製は、標準の設備を使用しました。ラボスケールのクロマトグラフィー精製プロセスは、続いて62.5倍にスケールアップしました。スケールアップのプロセスでは、50 L細胞培養からのダウンストリーム精製に、ReadyToProcess™シングルユース設備を使用しました。
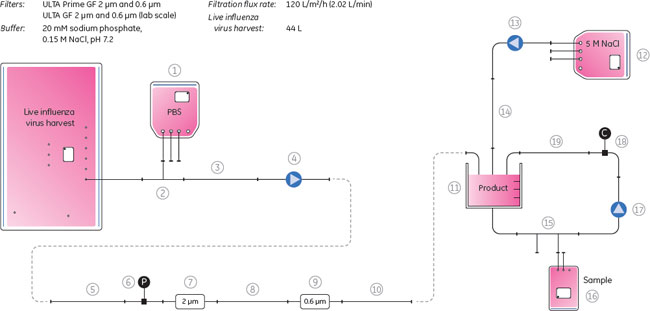
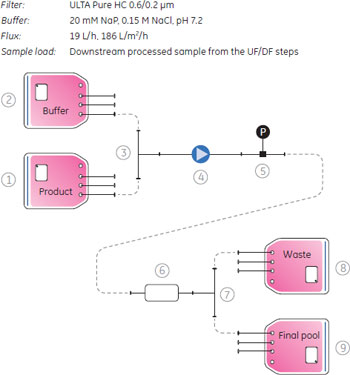
細胞培養と感染Vero細胞の10 Lのラボスケールでの培養はWAVE Bioreactor™ SYSTEM 20/50で行い、50 Lのスケールアップ培養はWAVE Bioreactor™ SYSTEM 200で行いました。細胞は、3 g/Lの濃度に調製したCytodex™ 1マイクロキャリアを使用し、ウシ胎児血清(50 g/L)とPluronic™ F-68(Sigma-Aldrich Co., 2 g/L)を添加したDulbecco's modified eagle medium (DMEM)/Ham's F12 中で行いました。ウイルス感染の前に、血清フリーのDMEM/Ham's F-12.で細胞を洗浄しました。およそ2×106 cells/mlの細胞濃度において、4×10-3の感染多重度(MOI、細胞数に対する感染させるウイルス粒子の数の割合)とトリプシン濃度2mg/Lの条件で感染しました。 ハーベストの前に、マイクロキャリアーはCellbag™バイオリアクターチャンバーに入れました。ウイルスは感染後3日から4日後に回収しました。回収の時間は、細胞変性の効果の外観的検査とウイルス粒子測定に基づき決めました。 より詳しい細胞培養、ウイルス感染および回収については、アプリケーションノート(参考文献3)に記載しました。 ReadyToProcess™を用いたインフルエンザウイルスの精製細胞回収(清澄化)ReadyMate™無菌コネクター、ReadyCircuit™ディスポーサブルチューブアセンブリー、およびセンサーを使用した密封系のシステム内で、ノーマルフィルトレーションで清澄化を行いました。清澄化のプロセスのアウトラインは図3に示しました。清澄化に使用する全ての溶液は、使用する前に滅菌フィルターを通して、ReadyCircuit™シングルユースプラスチックバッグに入れました。チューブとグラスファイバーデプスフィルターULTA™ Prime GFカプセルのプライミングは、Watson-Marlow™ポンプの流速キャリブレーションと同時に行いました(Watson-Marlow™ Pumps Group, Cornwall, UK)。
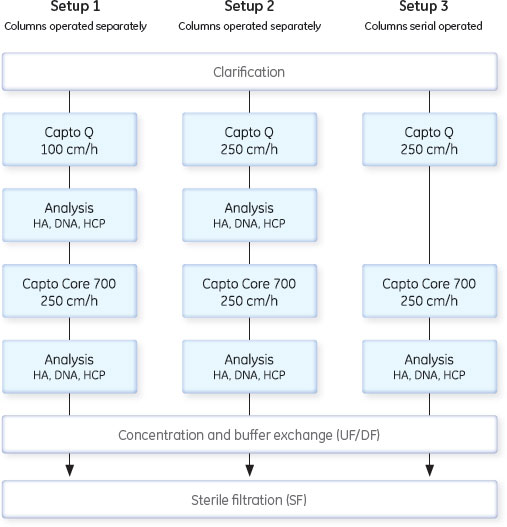
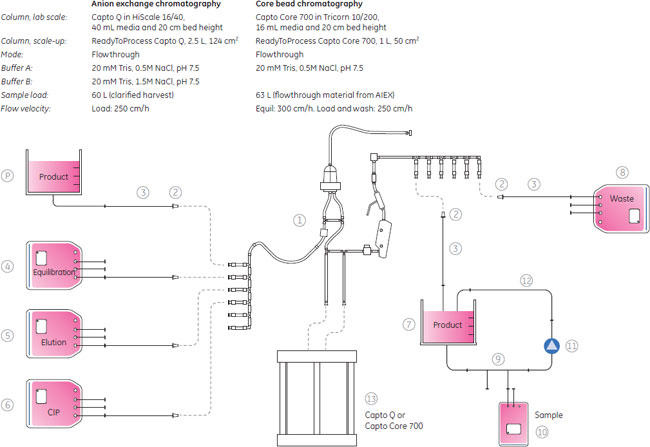
インフルエンザウイルスが含まれる培養液はULTA™ Prime GFカプセルを直列で2本接続したフィルターにペリスタルティックポンプで送液しました(120 L/m2/h)。PBS緩衝液はシステムのプライムやリンスに使用しました。清澄化した培養液は、100 L容のReadyCircuit™バッグに集めました。 これに続くクロマトグラフィー精製のために、5 M NaClを使用し、電気伝導度をおよそ48 mS/cmに調整しました。清澄化培養液は電気伝導度が一定になるまで、ペリスタルティックポンプで混合しました。サンプルバッグは混合サイクル上に接続されて、clave portを介してサンプリングされます。回収したサンプルは、ヘマグリチニン(HA)、ホストセルタンパク質(HCP)および総タンパク質解析用に+5℃、ホストセルDNA解析のために-70℃で保存しました。 クロマトグラフィー設定と条件の予備検討予備検討を目的として、スケールアッププロセスを含む全プロセスが、Capto™ QやCapto™ Core 700を別々あるいは連続して作業した場合、どのように影響を受けるかを評価しました。ラボスケールにおいて、インフルエンザウイルスを使用し、異なる線流速でテストしました。予備検討実験のスキームは図4に示しました。予備検討は、HiScale™ 16/40カラムにプレパパックしたCapto™ Q担体40 mlとTricorn™ 10/200カラムにプレパックした16 mlのCapto™ Core 700を用い、素通りモードを使用し、20 mM Tris, 0.5 M NaCl, pH 7.5の緩衝液を平衡化緩衝液として使用して行いました。
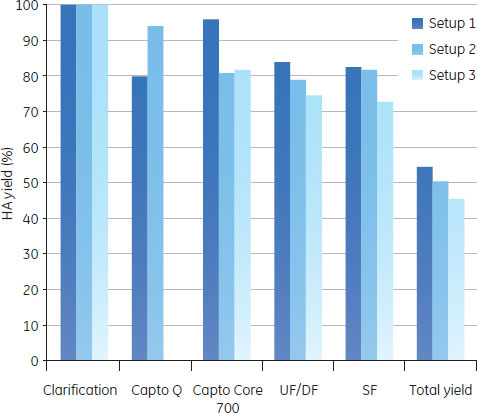
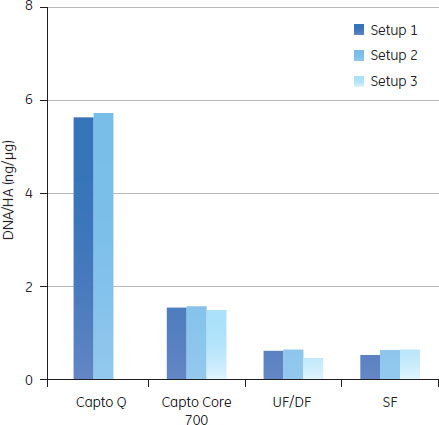
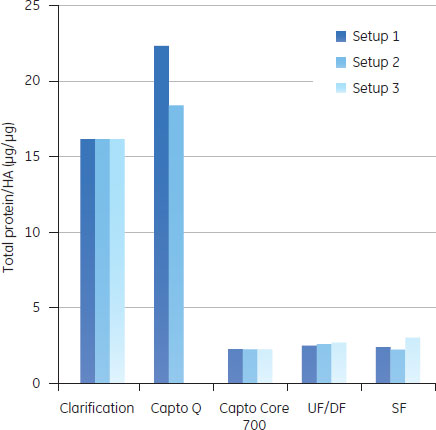
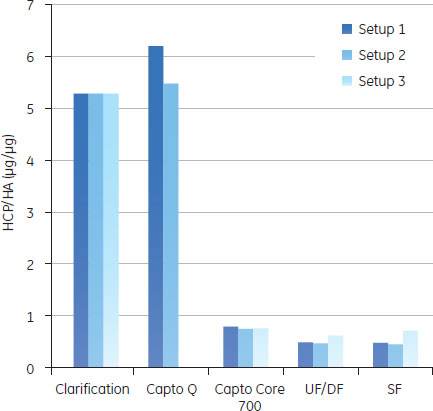
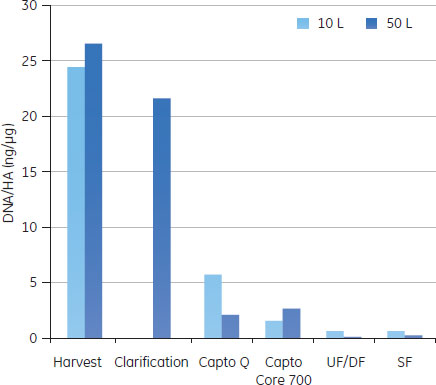
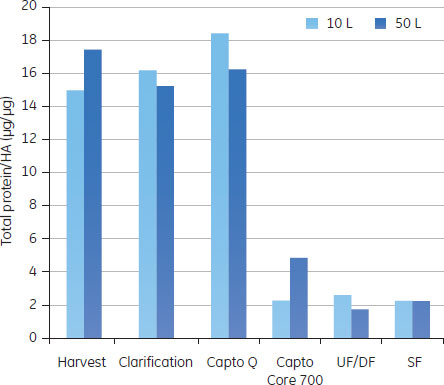
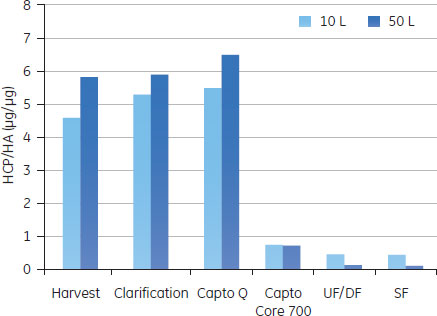
予備検討の結果図5のAからDに、予備検討の結果を、HA収率(%)、ホストセルDNA/HA割合、総タンパク質/ HA割合、HCP/HA割合をまとめました。
3つの全てのスキームで、最後の滅菌ろ過を経たプロセス回収率は同様のものでした。ラボスケールでの予備検討では、連続で行う複数のクロマトグラフィーとそれぞれ別々に行った場合を比較しても、同じプロセス収率および純度が得られ、プロセス時間を有意に減少できることが示されました。 クロマトグラフィーホストセルDNAからのウイルス精製に、ÄKTA ready™クロマトグラフィーシステムと2.5 LのReadyToProcess™ Capto™ Qカラムを使用しました。電気伝導度をおよそ48 mS/cmに調整(予備検討の部分に記載)して、ウイルスを素通りさせ、強く負に荷電しているDNAを正に荷電している担体のQの官能基に結合させました。Capto™ QカラムにDNAは3.5 mg/mlでロードし、250 cm/hの線流速を使用しました。Capto™担体の構造により、高い線流速にもかかわらず、カラムにかかる圧力は0.7 barと低く抑えられました。 続く精製ステップでは、HCPや疎水性物質のような不純物は1 LのReadyToProcess™ Capto™ Core 700カラム(ベッド高20 cm)で除去しました。Capto™ Core 700は、アガロース担体の外側(Shell)が不活性(inactive)で内側(Core)がマルティモーダルのリガンド(オクチルアミン)が結合している構造をしています。分子量がおよそ700,000以上の分子は担体の外側を通過し、より小さな分子は担体内に拡散し、内側のcoreのリガンドと結合します。不純物とオクチルアミンの結合は、pH、電気伝導度や通常の緩衝液組成の影響をうけません。Capto™ Core 700のタンパク質結合容量は、およそ13 mgオボアルブミン/ml担体です。タンパク質はおよそ7.5 mg/ml担体でロードし、線流速は250 cm/hで行いましたが、この時の圧力は0.4 barでした。 図6に実験条件とクロマトグラフィーのスキームをまとめました。
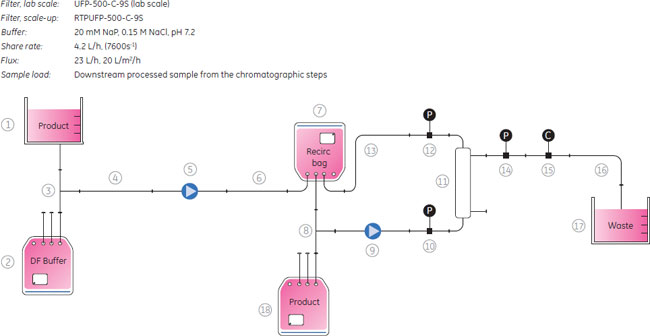
クロマトグラフィー精製ステップからのサンプルは、100 LのReadyCircuit™バッグから250 mlのサンプルバッグを介して回収し、それに続く回収率および純度分析に使用するため保存しました。 濃縮と緩衝液交換濃縮と緩衝液の交換は、ReadyToProcess™ホローファイバーカートリッジによる限外ろ過と透析ろ過により行いました。 ウイルス溶液は限外ろ過を用い63 Lから2.7 Lまで濃縮しました。透析ろ過を用いてウイルス粒子は最終滅菌ろ過に適する緩衝液に交換しました。
滅菌ろ過滅菌ろ過の前にチューブ、ポンプ、圧力センサおよびフィルターの流路を緩衝液でプライムし、液漏れがないかを調べました。実験スキームを図8に示しました。
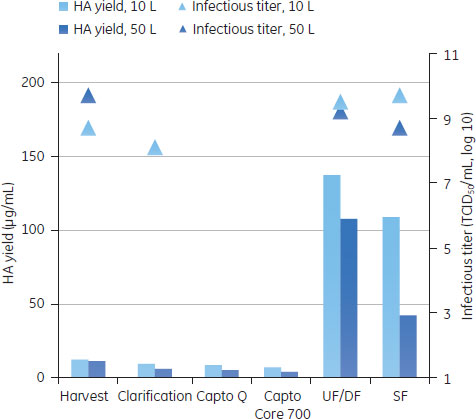
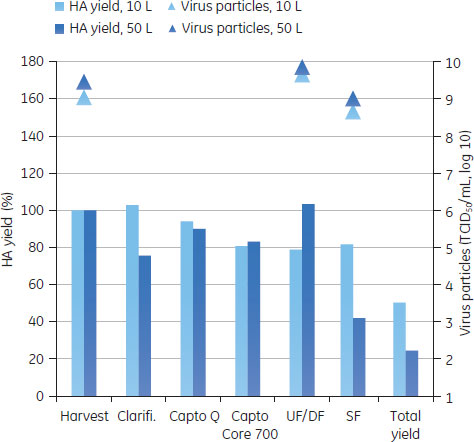
バッグ、チューブやフィルターなどのシングルユース製品は、1 Mの水酸化ナトリウムで処理し、廃棄の前にオートクレーブをして地域の条例に従って廃棄しました。システムは密封系であるので廃棄前にチューブ、バッグおよびフィルター中のウイルスを不活化する必要がない場合もあります。 分析方法ウイルス量の測定感染フェーズおよびクロマトグラフィー精製の段階で取ったサンプルは、50%組織培養感染量(TCID50)、Virus Counter 2100 (ViroCyt™, Denver, CO, USA)および分子間相互作用解析装置Biacore™ T200を用いたHA濃度の定量からウイルス活性を測定しました(参考文献4,5)。より詳細はアプリケーションノートに記載があります(参考文献3)。 不純物の定量ホストセルDNAホストセルDNAはVero細胞のS4x rRNA遺伝子に特異的なプライマーを使用した定量PCRで測定しました。ゲノムDNAのサンプル調製には、illustra™ GFX™ PCR DNA and Gel Band Purification Kitを使用しました。Vero細胞からのゲノムDNAの精製は、illustra™ tissue and cell genomicPrep Midi Flow Kitを使用しました。 総タンパク質アッセイ総タンパク質のアッセイには、Bradford法を用いました(参考文献6)。 ホストセルタンパク質ホストセルタンパク質の定量はセンサーチップCM5を使用したBiacore™ T200で行いました。Vero細胞溶解液のタンパク質に特異的なポリクローナル抗体を社内で作製し、センサーチップ表面に固定化しました。サンプルをインジェクションし、HCPをセンサー表面に固定化した抗体に結合させました。Vero細胞溶解液を用いた検量線は、それぞれの分析で、反応の初期、中間、および後半のポイントで取りました。サンプル中の濃度の正確性を高めるために、これらの検量線カーブはノーマライズに使用しました。 結果と考察ReadyToProcess™製品を用いたスケールアップ実験10 Lと50 Lに生産スケールにおけるインフルエンザウイルス精製プロセスの各ステップ(清澄化溶液、クロマトグラフィー、限外ろ過および透析ろ過)における結果を図9AからEに示しました。
スケールアップ研究におけるダウンストリーム精製の全体の所要時間は3日間で、ラボスケールでのインフルエンザのプロセス回収率と純度と比較し、同等な結果が得られました。HA回収率は50 L培養で25%、10 L培養で50%でした。ステップやスケール間での違いは、分析方法に由来する変動の可能性があります。最終滅菌ろ過の際のHAやウイルスの回収率の低下は、ウイルスのサイズと滅菌フィルターのポアサイズが近いからであると思われます。 Regulatory specificationsの比較2013年現在、市場には細胞培養由来の弱毒生ワクチンはないので、不純物に関する法的要求は確立されていません。したがって、スケールアップ生産の結果は、市販されている経鼻弱毒生ワクチンおよび鶏卵ベースの不活化スプリットインフルエンザワクチンのWHOによる仕様と比較しました(表1)。
0.2 mlの経鼻投与で107個粒子が感染したと仮定すると、スケールアップした生産物では、ホストセルDNA量がWHOで規定している許容レベル(10 ng/dose)より低くなることが示されました。スケールアップ生産の結果は、鼻弱毒生ワクチンの仕様をベースに計算した場合、1 Lの清澄化培養液から、およそ3000投与量のワクチンが得られますので、100万人への投与のために325 Lの培養液が必要となります。また、不活化スプリットワクチンの仕様をベースに計算すると、1 Lの清澄化培養液から175投与量がワクチンが得られますので、100万人への投与のためには5760 Lが必要となります。 まとめこの研究で、ReadyToProcess™プラットフォームを用いた細胞ベースのインフルエンザウイルスの50 L細胞培養液からのダウンストリーム精製で、ウイルスの感染性を維持したまま細胞由来の不純物を効率よく除去し、高い生産性があることが示されました。細胞培養液10 Lの標準設備での生産から、50 Lのシングルユース技術を用いてスケールアップしたインフルエンザウイルス生産でも、同様なプロセス回収率および純度が得られました。 本稿のケーススタディーでは、プロセスは完全に最適化されてはいません。ワクチン生産に使用される前に、プロセスのより一層の最適化が必要です。 参考文献
お問合せフォーム※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。 お問い合わせありがとうございます。 |
||
© 2025 Cytiva