|
|||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
|||||||||||||||||||
|
Location:Home > テクニカル情報配信サービス > Pharma Mail |
|||||||||||||||||||
ÄKTA™システムを用いた同時プロセシングによる全体のプロセス時間短縮とタンパク質の保護BioProcess™ International 5(7)(2007年7月/8月)より許可を得て転載 タンパク質は極めて複雑な分子タンパク質の生物活性は、多くの場合、構造に依存します。タンパク質の構造の崩壊や変化が起こると、タンパク質の生物活性が失われることがあります。タンパク質は、細胞培養液内に発現された瞬間から、生物活性に関係する要素が変化を受けやすくなります。そのような変化は、プロテアーゼやグリコシダーゼなどの細胞内酵素による酵素的な攻撃、不適切な溶液環境による凝集体形成、熱非安定性による構造の崩壊によって生じます。すべてのケースにおいて生物活性の損失は時間との勝負です。したがって、タンパク質を細胞内夾雑物から精製し安定な環境に置く処理が迅速であるほど、タンパク質の生物活性を維持できる可能性が高くなります。 さまざまなろ過技術やクロマトグラフィー技術を含む、多くの連続的な操作が関与しているため、タンパク質の発現から精製までの時間を最小限に抑えるのは実際には困難です(図1)。多くの場合、次の操作の準備に時間がかかったり、次の操作を開始する作業者が不在であったりと、次の操作までには長い待機時間を要します。このような待ち時間のために、生物活性が大幅に低下することもあります。
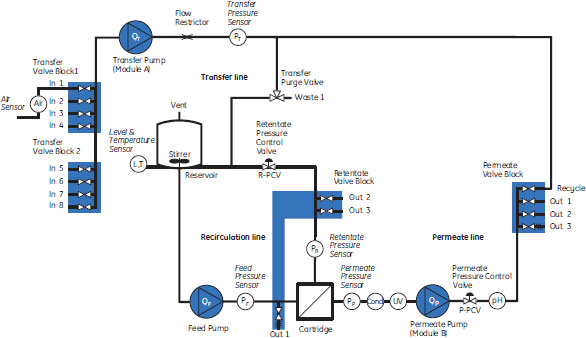
生物活性を保持するために、作業を連続的かつ同時に行うことで操作を統一化し、次の操作までの時間の経過をなくす方法があります。そのうちの1つでも手動で行われている場合、操作の統一化は複雑で煩雑なものとなります。しかし、プロセスを自動化すれば同時操作を簡単に実現できます。ここでは、クロマトグラフィー操作とろ過操作を統合した同時プロセシングを、清澄化工程と初期精製工程を例に取って説明します。これは、目的タンパク質を酵素などの細胞内夾雑物から精製する前の初期の精製プロセスであるため、時間の短縮が生物活性の保持に劇的な影響を与える非常によい事例となります。 同時プロセシング清澄化にクロスフローろ過(CFF)を使用する場合は、細胞培養液を孔径約0.2 µmのフィルターに通して循環させます。細胞はフィルターの孔にトラップされ、循環する濃縮液中に保持されます。その一方、液体とタンパク質はフィルターを通過し透過液に入ります。細胞をフィルターの一次側で濃縮したら、細胞を洗浄(ダイアフィルトレーション)し、濃縮された細胞塊中に残留する目的タンパク質を(フィルターを通じて)洗い流すのが標準的な操作法です。クロスフローろ過で得た透過液(目的タンパク質と夾雑物を含む)は、クロマトグラフィーカラムにリアルタイムに直接添加するのに理想的で、そうすることにより、清澄化と同時に初期精製が行えます。また、クロスフローろ過技術はプロセスの自動化に最適です。 自動クロマトグラフィーシステムは、長年にわたり、バイオ医薬品の研究室で日常的に使用されてきました。しかし、(クロマトグラフィー工程と同じ研究室で実施される)ろ過工程は依然として手動で行われています。Cytivaは近年、清澄化と限外ろ過/ダイアフィルトレーションなどのクロスフローろ過技術を行う完全自動化ろ過システムである、ÄKTAcrossflow™を発売しました。ÄKTAcrossflow™はろ過工程を完全自動化できる、研究室スケールにおける最初のシステムです。ÄKTAcrossflow™(図2)は、ポンプ、圧力制御弁、入口弁、出口弁、センサーを組み合わせ、このプロセスの完全自動化を可能にしています。このシステムはÄKTA™クロマトグラフィーシステム(世界中で80,000人を越える科学者が使用)と同じソフトウエアプラットフォーム(UNICORN™)を採用しています。ÄKTAcrossflow™と最も近いスケールであるÄKTA™クロマトグラフィーシステムは、ÄKTA™explorer 100です。以下の同時プロセシングの実施例には、これら2種類のシステムを使用しています。
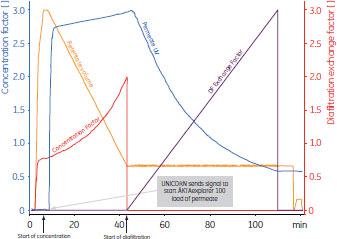
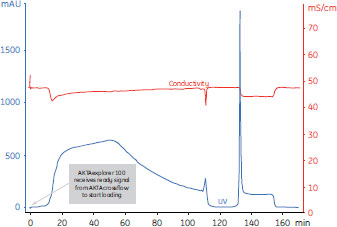
近年のÄKTA™designシステムコントロールの発展により、自動化システム(ÄKTAcrossflow™やÄKTA™explorer 100など)同士を接続できるようになり、同時プロセシングを可能にしています。これにより、次の操作までの待機時間がなくなり、細胞培養からタンパク質精製までの時間が短縮されるため、生物活性を保持できます。プロセス全体が、連続的で、手動操作を必要とせず、ボタンを押すだけの簡単操作で行え、各操作のプロセシングデータと実験結果を完全に記録します。 同時プロセシングの実施例この実施例では、ヒスチジンタグを結合したGFPタンパク質(GFP:Green Fluorescent Protein)を含む酵母培養液を0.2 µmのホローファイバーカートリッジを用いて清澄化しました。この清澄化プロセスは、酵母培養液を2回濃縮し、3回ダイアフィルトレーションしています。これにより、GFPの回収量を高めることができました。清澄化に続いて、Ni Sepharose™ 6 Fast Flowを充填したHisPrep™ FFアフィニティークロマトグラフィーカラムを用いて目的タンパク質の初期精製を行っています。 従来のプロセシングでは、清澄化工程と初期精製工程は別々に実施されていました。透過液は、清澄化の全工程を通じて回収され、時間の制約がなければ、引き続きアフィニティーキャプチャーカラムに添加します。ここでタンパク質は担体に固定化され、酵素的分解や他の潜在的な修飾作用に対して安定化されます。時間に制約があり、引き続きアフィニティーカラムに添加できない場合は、透過液を次の精製まで4℃で保存します。低温で保存することで、変化を遅らせることができますが、完全に防げるわけではありません。 清澄化とキャプチャーを同時にプロセシングする場合、清澄化で得られた透過液は回収せず、ろ過後、そのままキャプチャーカラムに送ります。ろ過システム(ÄKTAcrossflow™)からクロマトグラフィーシステム(ÄKTA™explorer)に信号が送られ、最適なタイミングで操作を開始する仕組みにより、UNICORN™が両システムの同時プロセシングを制御します。 このようにして、カラムへの添加が清澄化と同時に実行され、このカラムで目的タンパク質を固定、保護します。UNICORN™による清澄化とキャプチャーを同時にプロセシングした結果を図3および図4に示します。
その他ダウンストリームでの用途ÄKTAcrossflow™とÄKTA™explorerの組み合わせと、ろ過とクロマトグラフィーの同時プロセシングにより、時間短縮と手動操作を必要としない利便性を実現した応用事例は他にも数多くあります。例えば、限外ろ過とクロマトグラフィーのプロセスを使用する事例では、限外ろ過とダイアフィルトレーションが完了した時点で、正確にUNICORN™がクロマトグラフィープロセスを開始するというメリットが得られます。回収された濃縮液はÄKTA™explorerに送られ、クロマトグラフィープロセスが始まると、ÄKTAcrossflow™がフィルターの洗浄復帰を開始します。UNICORN™は、両システムを自動的かつ同時に操作します。 まとめ研究室スケールでのろ過とクロマトグラフィーのプロセスのプロセシングにÄKTAcrossflow™とÄKTA™explorer 100を使用すれば、2つのシステムを同時に実行し、プロセシングの完了までに要する時間を短縮することができます。これは、ÄKTA™design UNICORN™制御により可能になります。次のプロセスまでの待機時間が長くなることがタンパク質構造が変化につながることを考えると、この特徴を利用することで、目的タンパク質の生物活性を保持できるというメリットが得られます。また、全く手動操作を必要とせずプロセス技術同士を統合でき、プロセスを完全に文書化できるというメリットもあります。 お問合せフォーム※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。 お問い合わせありがとうございます。 |
|||||||||||||||||||
© 2026 Cytiva