ソリューション4
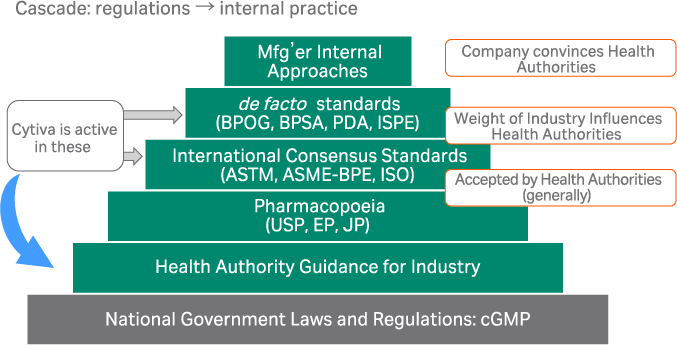
革新的技術の規制動向を把握業界団体や規制当局との取組み
バイオ医薬品製造の現場において、たとえばシングルユースシステムは普及しつつありますが、品質確保や品質試験の標準化など、クリアすべき課題がまだ残っています。
医薬品の品質に関するガイドラインは、最終的には規制当局が定めますが、実現可能なものにするためにはユーザーである医薬品製造企業とCytivaを含めたサプライヤーが、共に規制当局に働きかけることが重要です。
医薬品の品質に関するガイドラインは、最終的には規制当局が定めますが、実現可能なものにするためにはユーザーである医薬品製造企業とCytivaを含めたサプライヤーが、共に規制当局に働きかけることが重要です。
業界団体や学会とともに弊社が現在取り組んでいる課題
Integrity / Leak management
サプライヤーによるシングルユース製品製造時のリーク試験の標準化およびユーザーの工場における管理体制について、ドラフトを作成中です。
変更通知書の内容とタイミング
通知の内容がリスクにもとづいた情報であるか、連絡のタイミングが適切であるかなど、ユーザーとサプライヤー間の期待値をすり合わせしています。
Extractables
BPOG(下参照)のプロトコールが実質的なスタンダードになっており、Cytivaの製品はこれに準拠しています。米国薬局方が665章にドラフトとして記載しています。
参加している団体、学会例
BPOG(BioPhorum Operations Group)
www.biophorum.com
世界のバイオ医薬品産業が協力して、医薬品の上市を加速できる環境づくりをミッションとして設立された業界団体です。
2017年現在、5つのフォーラムに22名の本社スタッフが参加しています。
BPSA(BIO-PROCESS SYSTEMS ALLIANCE)
bpsalliance.org
シングルユースシステムの適応および導入を促進するために、サプライヤーのみで構成される業界団体。
本社スタッフが技術的な分科会にて議長を務めたほか、BPSA創立当時の副議長を務めるなどの経験があリます。
PDA(Parenteral drug association)
www.pda.org
テクニカルレポートNo.66(Application of Single-Use Systems in Pharmaceutical Manufacturing)について執筆者として参加しています。