
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Location:Home > サポート・保守情報 > お客さまの声・データ紹介 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
お客さまの声/データ紹介 HisTrap™ HP その1His-tagタンパク質精製用カラム
高結合容量が特長のNi Sepharose™ High Performanceがパッキングされた、HiTrap™タイプのカラムです。シリンジ、システム操作に対応します。
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 名称 | ヒト脳に発現する膜タンパク質(レセプター)のC末端部分(細胞質側)79アミノ酸 |
|---|---|
| 濃度 | 20 mM Sodium phosphate, 0.5 M NaCl, pH7.4 |
| 添加剤 | 8 M Urea, 2 mM DTT |
| 発現系 | 大腸菌 |
[精製条件]
| 結合バッファー: | 20 mM Sodium phosphate, 0.5 M NaCl, 8 M Urea, 2 mM DTT, 20 mM Imidazole, pH7.4 |
|---|---|
| 溶出バッファー: | 20 mM Sodium phosphate, 0.5M NaCl, 8 M Urea, 2 mM DTT, 500 mM Imidazole, pH7.4 |
| 溶出条件 : | グラジエント、ステップワイズ |
[使用システム]
ÄKTA™explorer 10S
[サンプル調製およびHisTrap™ HPによる精製]
- 発現ベクターを導入した大腸菌を培養し、目的融合タンパク質の発現を誘導(培養量1 L)
- 集菌後、超音波で菌体の破砕
使用バッファー:20 mM Sodium phosphate, 0.5 M NaCl, pH7.4 - 遠心後、沈殿画分を8 M Urea を含むバッファーで可溶化
可溶化バッファー:20 mM Sodium phosphate, 0.5 M NaCl, 8 M Urea, 2 mM DTT, pH7.4 - 可溶化後のサンプルにQ Sepharose™ XLを添加(1時間インキュベート)
- 遠心後、上清を0.45 µm フィルターでろ過してサンプルとした
結果
[収量の比較]
| 収量 | 約1~2 mg |
|---|---|
| 回収率 | 約80~90% |
| 純度 | 80~90% |
データ
【リニアグラジエント溶出の結果】
★リニアグラジエント溶出による精製後の電気泳動結果
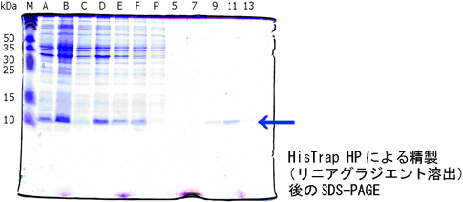
- A: 培養液
- B: 超音波破砕液
- C: 遠心後の上清
- D: 沈殿画分を8 M Ureaを含むバッファーで可溶化
- E: Q Sepharose™ XL処理後の遠心上清
- F: サンプル
- P: 素通り画分
- 5: 溶出素通り画分5
- 7: 溶出画分7
- 9: 溶出画分9
- 11: 溶出画分11
- 13: 溶出画分13
【ステップワイズ溶出の結果】
★ステップワイズ溶出による精製後の電気泳動結果
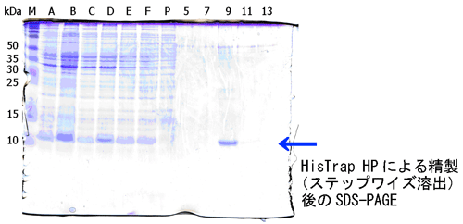
- A: 培養液
- B: 超音波破砕液
- C: 遠心後の上清
- D: 沈殿画分を8 M Ureaを含むバッファーで可溶化
- E: Q Sepharose™ XL処理後の遠心上清
- F: サンプル
- P: 素通り画分
- 5: 溶出素通り画分5
- 7: 溶出画分7
- 9: 溶出画分9
- 11: 溶出画分11
- 13: 溶出画分13
結果についてのコメント
HisTrap™ HPによる今回のヒスチジンタグ組換えタンパク質の精製結果は、回収率、精製純度ともに満足できる結果であった。さらに純度をあげるために、陰イオン交換カラムにより精製を行う予定でいたが、本実験の仕様ではHisTrap™ HPによる1ステップ精製の純度で十分であったので本精製品をそのまま使用した。
同じカラムを用いて3回精製を繰り返したが、再現性よく同じ結果が得られた。
北海道大学大学院理学研究科 生物科学専攻 生体高分子解析学講座
出村 誠 先生、相沢 智康 先生、久保 恵美 様
HisTrap™ HPを使用した感想
- 目的タンパク質を高純度に精製することができた。
- 再生後でも問題なく精製ができ、再現性のある結果が得られた。
背景
- サンプルは7回膜貫通型タンパク質ハロロドプシン(多量体)。分子内に発色団としてレチナールを持つホロタンパク質は、578 nmに吸収を持つ。
- 方法、結果に示したサンプル濃度、収量、回収率は、活性型の極大吸収波長578 nmのモル吸光係数から計算された。このタンパク質には活性のないアポタンパク質が3~12倍程度存在すると予想される。
- 従来の精製方法
- Dodecyl maltosideで大腸菌膜画分を可溶化 (16時間)
- 超高速遠心分離(40,000 rpm, 30分)後、上清をサンプルとして使用
- 担体スラリー液とサンプルをインキュベート(バッチ法)
- 担体の3倍量の洗浄バッファーで洗浄
- 溶出バッファーで溶出、フラクショネーション
実験方法
[サンプル]
| 名称 | ハロロドプシン(膜タンパク質) |
|---|---|
| 溶液・濃度 | 23 ml, 0.24 mg/ml |
| 添加剤 | 0.1 % Dodecyl maltoside |
| 発現系 | 大腸菌 |
[精製条件]
| 結合バッファー: | 0.1 % Dodecyl maltoside, 50 mM MES(pH 6.5), 300 mM NaCl, 5 mM Imidazole |
|---|---|
| 洗浄バッファー: | 0.1 % Dodecyl maltoside, 50 mM MES(pH 6.5), 300 mM NaCl, 50 mM Imidazole |
| 溶出バッファー: | 0.1 % Dodecyl maltoside, 50 mM Tris(pH 7.0), 300 mM NaCl, 150 mM Imidazole |
| 溶出条件: | ステップワイズ |
※1 ハロロドプシンの精製に関する以下の論文を参照。検討の上、独自に条件を至適化した。
- Hohenfeld IP, Wegener AA, Engelhard M.Purification of histidine tagged bacteriorhodopsin, pharaonis halorhodopsin and pharaonis sensory rhodopsin II functionally expressed in Escherichia coli. FEBS Lett. 1999 Jan 15;442(2-3):198-202.
結果
| 収量 | 収量:5.0 mg |
|---|---|
| 回収率 | 89% |
データ
結果はPDFデータをご覧ください。
→ SDS-PAGEによる純度確認(PDF:27KB)
結果についてのコメント
- 精製サンプルのSDS-PAGEの結果から、HisTrap™ HPの方が従来法よりも目的タンパク質を高純度に精製できた(Fig. 1、Fig. 2-B 溶出)。
- 洗浄画分では目的タンパク質の溶出は見られなかった(Fig. 2-B 洗浄)。
- 素通り画分(Fig. 2-A)の活性型タンパク質量はA578測定結果から無視できる量であった(データ未掲載)。
- 担体の再生に関しては、使用するバッファーが少なく(2種類だけ)従来法(他社製品使用)の推奨プロトコールよりも簡便であった。また、再生後のHisTrap™ HPでも再現性よく精製することができた。
東京医科歯科大学大学院疾患生命科学研究部
伊倉 貞吉 先生
HisTrap™ HPを使用した感想
- 1回の精製で高純度の精製タンパク質を高収率で得ることができた。
- 還元剤が利用できる範囲が広い。5 mM 2-メルカプトエタノール、1 mM DTTともに、カラムの変色等なく使用することができた。
- 同じカラムを2回使用したが2回とも同等の結果が得られた。
実験方法
[サンプル]
| 名称 | 大腸菌シクロフィリンA |
|---|---|
| 溶液・濃度 | 30 ml, 1 mg/ml(大腸菌破砕液のため、正確な濃度は不明) |
| 発現系 | 大腸菌 |
[精製条件]
| 結合バッファー: | PBS, 0.5 M NaCl, 5 mM 2-メルカプトエタノール, 20 mM Imidazole, pH7.4 |
|---|---|
| 溶出バッファー: | PBS, 0.5 M NaCl, 5 mM 2-メルカプトエタノール, 500 mM Imidazole, pH7.4 |
| 溶出条件: | ステップワイズ |
[操作方法]
シリンジ(流速:1 ml/min)
[サンプル調製の方法]
- シクロフィリンAドメインをT7ベクターに導入し、大腸菌細胞質内でHis-tagシクロフィリンAを大量に発現させた。
- 菌体を回収後、PBS, 2-メルカプトエタノールで再懸濁し超音波処理で細胞を破砕した。
- 遠心分離した上清を回収し、フィルターろ過してサンプルとした。
- HisTrap™ HPにサンプルを添加した後、5カラム体積の結合バッファーでカラムを洗浄した。
- 3カラム体積の溶出バッファーで目的タンパク質の溶出・回収を行った。
結果
| 収量 | 30 mg |
|---|---|
| 回収率 | 99% |
データ
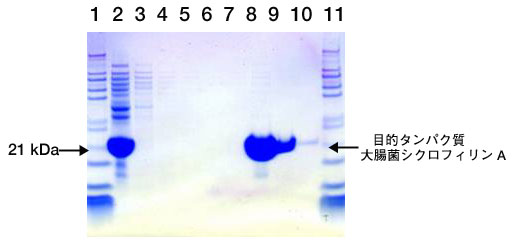
図 HisTrap 精製後のSDS-PAGE結果 (CBB染色)
【各レーンに泳動したサンプル】
- 1, 11:分子量マーカー
- 2:大腸菌破砕液 (遠心分離、フィルターろ過済)
- 3-7:素通り画分(1)、(2)、(3)、(4)、(5)
- 8-10:溶出画分(1)、(2)、(3)
お問合せフォーム
※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。
お問い合わせありがとうございます。
後ほど担当者よりご連絡させていただきます。
© 2026 Cytiva
