|
|||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
|||||||||||||||||||||||||||||||||||||||||||||
|
Location:Home > 実験手法別製品・技術情報 > セルラーサイエンス |
|||||||||||||||||||||||||||||||||||||||||||||
IN Cell Analyzer 2000を用いた幹細胞コロニー解析はじめに幹細胞研究は、さまざまな疾病に関する理解を深め、治療法に関する多くの知見が得られると期待されています。幹細胞はさまざまな表現型に分化する能力(分化全能性)を持ち、その分化能は培養条件に大きく依存しています。数多くの培養条件をこなすためマルチウェルプレートのようなフォーマットでの検討が必要となります。 その点、自動化された蛍光顕微鏡を有するイメージングサイトメーターでは、接着細胞であっても剥離する必要がなく効率的に作業できます。さらに細胞個々から蛍光強度の情報だけでなく形態情報、局在情報などのデータを取得できるという利点があります。形態情報から未分化の細胞及び分化した細胞を区別するというようなアプリケーションにも応用できます。 幹細胞は、通常、密集したコロニー状態で増殖し、幹細胞に特異的なOct-4などのマーカーに対する抗体で検出します。マルチウェルプレートを用いたコロニー解析においては、撮影視野の端でコロニーが切れてしまうことなく、また、出現頻度の低いコロニーでも漏らさず検出することが望まれ、そのためには一度にウェル全体が撮影できるシステムが必要です。 今回、large-chip CCDカメラと2×レンズ(0.1 NA)とを組み合わせてハイスループットでホールウェル撮影を可能にするIN Cell Analyzer 2000を用いて幹細胞のコロニー解析を行った例をご紹介します。フィーダー細胞とコロニーの自動識別や、細胞数のカウントやコロニー数、コロニー中の細胞数の自動カウントのほか、有糸分裂中のM期細胞の認識を行いました。 使用した製品
サンプルおよび試薬
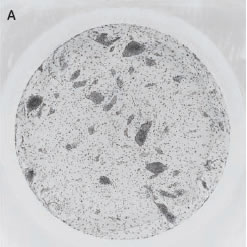
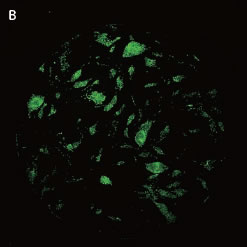
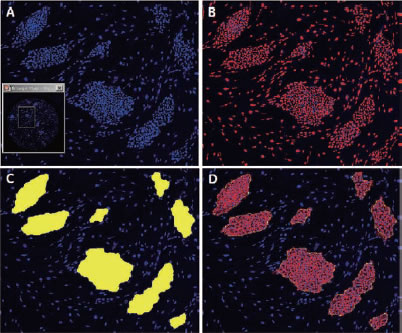
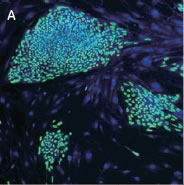
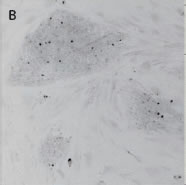
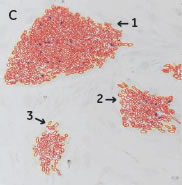
*Stem Cell Research Center, University of California, IrvineのPeter Donovan博士よりご提供いただきました。 実験方法96ウェルプレートに培養された幹細胞コロニーおよびフィーダー細胞を蛍光染色してから固定しました。核はHoechst™、幹細胞はFluorescein-conjugated antibody to Oct4、有糸分裂中(M期)の細胞はTexas red-conjugated antibody to phospho-histone H3で染色しました。詳細な手順や培養条件やの詳細は以下の論文を参照しました。 Elliott, A. et al., Identifying Genes Differentially Expressed Between PGCs and ES Cells Reveals a Role for CREB-Binding Protein in Germ Cell Survival. Dev Biol. 311 (2), 347-358 (2007). Pyle, A.D. et al., Neurotrophins mediate human embryonic stem cell survival. Nature Biotechnology, 24, 344-350 (2006) 結果IN Cell Analyzer 2000を用いて、2×レンズ(0.1NA)およびlarge-chip CCDカメラによるホールウェルイメージングを行いました(図1)。今回用いた96プレートのウェルサイズは直径6.5 mmに対し、視野サイズは7.6 mm四方となっています。解析ソフトウェアIN Cell Investigator Software(Developer toolbox)を用いて、Hoechst™の画像から全細胞およびOct-4の画像からコロニーを自動認識させました。さらに総細胞数のカウント、コロニー数のカウントおよびコロニー中の細胞数のカウントを行うことができます(図2)。 また、リン酸化ヒストンH3の免疫染色により有糸細胞分裂期の細胞をカウントすることができました(図3)。イメージングサイトメーターでは細胞、コロニーのカウントだけではなく、その形態を評価することが可能です。図3Cの1、2、3で示したコロニーに関して解析結果の一覧を示しました(表1)。目視では識別が難しい密集したコロニーであっても細胞のカウントや核の数、およびM期の細胞の検出を行うことができました。
まとめ
お問合せフォーム※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。 お問い合わせありがとうございます。 |
|||||||||||||||||||||||||||||||||||||||||||||
© 2026 Cytiva