ヒト幹細胞由来心筋細胞の開発およびバリデーションへの
イメージングサイトメトリー技術の応用
はじめに
安全に使用できるとして承認された薬剤が、後になって毒性の問題、多くの場合心毒性の発覚により回収されるケー
スがあります。このような問題を引き起こさないためには、薬剤開発の段階で生理学的に意味のある毒性試験が可能な心筋細胞を用いたモデルが必要です。弊社はヒト胚性幹(hES)細胞由来心筋細胞を、工業規模の細胞リソースとして提供することに成功し、hES 細胞から心筋細胞への分化について評価をするため、hES細胞由来心筋細胞のバリデーショ
ンを、核型、イオンチャネル機能、重要な心臓マーカーの発現等について、さまざまな手法でおこないました(1, 2)。本研究では、細胞ベースのハイコンテンツアッセイでの活用を目的に、心筋細胞のキャラクタライゼーション評価、抗不整脈薬アミオダロンを用いたマルチプレックス毒性試験を試みました。
実験内容
使用した製品
- IN Cell Analyzer 2000
- IN Cell Investigator Software
サンプル
免疫染色
心筋細胞をMatrigel コートしたプレートに播種し、37℃で48 時間インキュベートしました。この時点およびその後1日おきに培地交換をおこないました。通常3~6 日間インキュベートした後に、細胞を2%パラホルムアルデヒドで固定し、5
%血清/1%ヒトIgG によるブロックキングを2~8℃で20 分間おこないました。免疫染色では、一次抗体を添加して2~
8℃で1時間インキュベートし、次に二次抗体を添加して2~8℃で1時間インキュベートした後、洗浄しました。
細胞核はHoechst™ 33342 により染色しました。
毒性試験
心筋細胞をMatrigel コートした96 ウェルのμClear プレートに播種し、37℃で48時間インキュベートしました。この時点で培地交換をおこなった後、化合物を添加してさらに24時間インキュベートしました。細胞は、Hoechst™ 33342、Fluo-4
AM、Mitotracker Red CMXRos、およびTOTO-3 iodide で染色し、37℃で1 時間インキュベートした後、画像解析をおこないました。
画像取得
生細胞画像は、40×(0.6 NA)対物レンズを選択してIN Cell Analyzer 2000 により取得しました。固定細胞の画像は、前述のように2×、20×または40×(0.6 NA)対物レンズを用いたスタンダードチップまたはラージチップの
CCDカメラにより取得しました。画像はIN Cell Investigatorソフトウェアを用いて解析しました。
結果および考察
ハイコンテンツアナリシスによる心筋細胞のキャラクタライゼーション
播種密度の最適化は、コロニー形成率を決定し、培養における心筋細胞成熟の至適条件を確立する上で重要なステップです。IN Cell Analyzer 2000 のプレビュースキャン機能を用いて、プレート全体のプレビューイメージングを行い細胞の状態を確認しました(図1)。
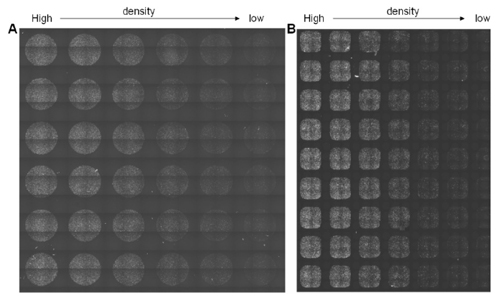
図1 プレビュースキャンにより本撮影前のプレートのチェック
96 ウェルフォーマットでは1 ウェルに80,000~2,500 個(A)、384ウェルフォーマットでは1ウェルに25,600~800
個(B)の密度になるように心筋細胞を播種しました。細胞を固定してHoechst™ 33342 で染色し、IN Cell
Analyzer 2000 によりプレビュースキャンの全体画像を取得しました。
播種密度実験のホールウェルイメージングにより、心筋マーカートロポニンI の発現が確認され、ウェル全体における心
筋細胞の均一な分布が確認されました(図2)。低倍率(2×)でも、画像の認識と細胞数測定に十分な解像度を有
していました(図3)。これにより1ウェルあたり40,000 個超の播種密度が最適であることが確認できました(図3、図
5B)ので、本研究ではその後の細胞のキャラクタライゼーションおよび毒性試験では、1 ウェルあたり40,000 個の播種密度を使用しました。

図2. ホールウェルイメージングによる細胞分布の確認
2×対物レンズでラージカメラを用いてIN Cell Analyzer 2000 により取得した、固定細胞のホールウェル画像。心筋細胞はトロポニンI 抗体およびCy5 標識二次抗体(赤)で染色しました。
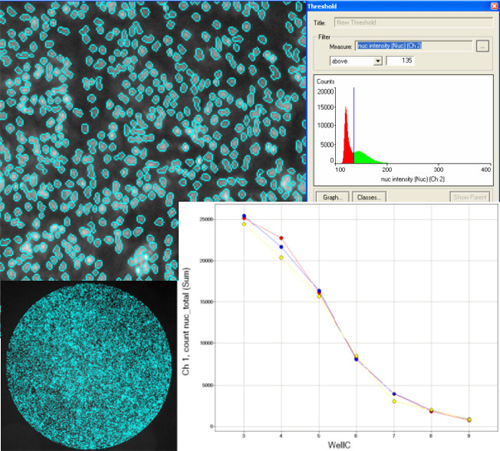
図3 播種条件最適化のための播種密度解析
1ウェルあたり80,000~2,500個の密度で心筋細胞を播種しました(96ウェルフォーマット)。2×対物レンズでラージカ
メラを用いてIN Cell
Analyzer 2000によりホールウェル画像を取得し、IN Cell Investigator
を用いて画像を解析しました。
心筋マーカー発現の評価と定量には、より高倍率の対物レンズを用いました。40×対物レンズを用いた画像取得により、分化した心筋細胞におけるトロポニンI 発現に特徴的な縞状の染色パターンが確認されました(図4)。
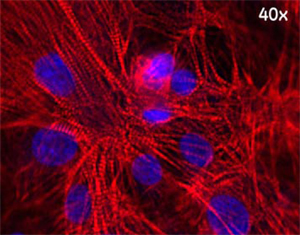
図4. 分化した心筋細胞に見られる特徴的な縞状パターン
40×(0.6 NA)対物レンズを用いてIN Cell Analyzer 2000 により取得した、固定細胞の画像。心筋細胞はトロポニンI抗体およびCy5標識二次抗体(赤)で染色しました。核はHoechst™ 33342(青)で染色しました。
IN Cell Investigator の画像解析プロトコルを用いて、最初にすべての核をHoechst™ 33342 により確認し、次にトロポニン
IおよびGATA-4 の含有量(それぞれCy5 とFITC の蛍光色素)に従い蛍光強度に基づくサブポピュレーション解析をおこないました(図5)。各細胞で、αアクチニンが発現して正しく局在していることも明らかになりました(図示せず)。
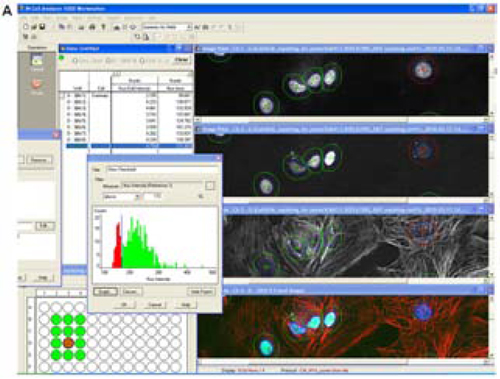
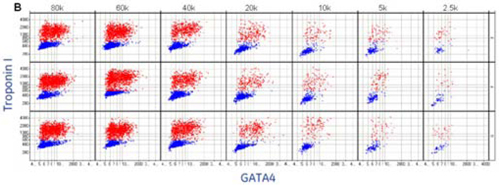
図5 心筋細胞のハイコンテンツアナリシスにより細胞のキャラクタライゼーションおよびポピュレーションが可能です。
(A)心筋細胞のトロポニンI およびGATA-4 の発現量(それぞれCy5 とFITC の蛍光色素)のIN Cell
Investigator 解析。
(B)(徐々に低下させた細胞密度における)トロポニンI およびGATA-4 発現の視覚化。
毒性試験
アミオダロンはクラスIII の抗不整脈薬で、陽イオンチャネルを遮断してアドレナリン拮抗薬として作用することも知られています(3)。心筋細胞をアミオダロンで処理すると、細胞およびミトコンドリアの形態が変化し、細胞質カルシウムが増加
すること(Fluo-4 蛍光強度の増加による)が示されました(図6)。画像解析により用量依存性の生存率の低下と核面積の減少が明らかになり、アミオダロンの高濃度での毒性作用と一致しました(図7A)。アミオダロンのミトコンドリアへの作用も、ミトコンドリア数の減少およびそれに対応するミトコンドリア形態変化として観察されました。コントロールの細胞では
ミトコンドリアの線維状のネットワークが認められますが(図6A)、アミオダロンで処理した細胞では明らかではなく(図6B、
図7B)、ミトコンドリアはより丸くて小さい構造になりました。
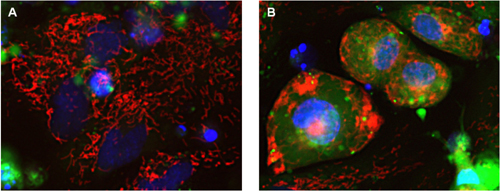
図6. 心筋細胞ミトコンドリアに対するアミオダロンの影響
40×(0.6 NA)対物レンズでIN Cell Analyzer 2000 により画像取得した心筋生細胞を用いた毒性試験。心筋細胞をコントロール(A)、または3.7 μM アミオダロン(B)で24 時間処理し、ミトコンドリアの状態
(Mitotracker Red CMXRos、赤)、カルシウム動態(Fluo-4、緑)、DNA/核の状態(Hoechst™ 33342、青)および細胞生存(TOTO-3、図示せず)について染色しました。
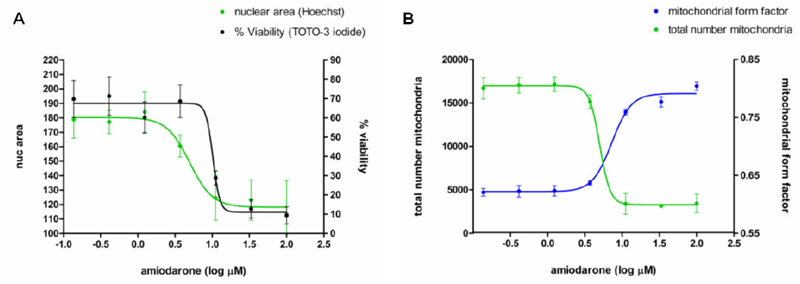
図 7. 生細胞を用いたアミオダロン心毒性試験の用量依存性
心筋細胞に各濃度のアミオダロンを24 時間曝露して、核面積(緑)と生存率(%、黒)(A)、ならびに細胞あた
りの総ミトコンドリア数(緑)とミトコンドリア形状因子(青)(B)の用量依存性を測定しました。データの非線形回帰
分析をおこないました(平均値±標準偏差、n=6)。
まとめ
- IN Cell Analyzer 2000 を利用することにより、心筋細胞(Cytiva)の分化状態の確認を迅速かつ
正確に行えました。
- 低倍率レンズの使用による播種密度の最適化および高倍率レンズによる心筋細胞構造の評価できました。
- 本画像解析の手法は、心筋細胞の表現型を指標にした、96 ウェルまたは384 ウェルのフォーマットで実施する毒性試験やスクリーニングに適しています。
参考文献
- Cardiotoxicology ? A New Stem Cell Derived cell Model. Ismail, R. et al. (Poster presented at
the 9th Annual World
Pharmaceutical Congress, June 15-17, 2010, Philadelphia, Pennsylvania).
- Comparison of Flow Cytometry and High Content Analysis for Stem Cell Research. Thomas,
N. et al. (Poster presented at
CYTO 2010: XXV Congress of the International Society for Advancement of Cytometry, May 8-
12, 2010, Seattle, WA, USA).
- Singh BN, Venkatech N, Nademanee K, Josephson MA, Kannan R. (1989) The historical
development, cellular
electrophysiology and pharmacology of amiodarone. Prog. Cardiovasc. Dis. 4, 249-280
関連製品
IN Cell Analyzer 2000の後継機種、IN Cell Analyzer 2200の詳細はこちらからご参照いただけます。


