
印刷用PDF
IN Cell Analyzer 2000を用いたゴルジ体への薬物作用機序解析
はじめに
細胞外に分泌されるタンパク質の糖鎖修飾などに関わるゴルジ体はストレス刺激に大きく関与しています(1)。一定以上の刺激が生じた場合、ゴルジ体はアポトーシスなどの機序を活性化することが報告され、がん研究や創薬開発の標的になり得ると考えられています(2)。また、微小管はゴルジ体の構造維持に必須であり(3)、微小管阻害剤はがんの化学療法で広く使用されています(4)。多くの薬剤の作用によりゴルジ体は形態変化を起こします。そのため、ゴルジ体の形態解析は、新規薬剤開発に利用できると共に、機能解析にも応用可能と思われます。
今回のゴルジ体構造のハイコンテンツアナリシスでは、ゴルジ体の網目構造の違いを区別する必要があるため、画像解析に耐えうる高解像度な画像を得る必要があります。IN Cell Analyzer 2000のハイコンテンツアナリシスシステムを利用することにより、網目構造の区別、ゴルジ体表現型の特性化、およびより高度なスループットスクリーニングへの応用に十分な品質の画像を取得することができます(図1)。
本アプリケーションノートでは、シスゴルジ網とトランスゴルジ網(TGN)を区別するために特異抗体を使用し、必要に応じてデコンボリューション技術(5)を用い被験物質により生じる局在性の変化を定量化しました。最後に、ゴルジ体構造の変化を標的としたスループットスクリーニングの使用可能性を検討しました。
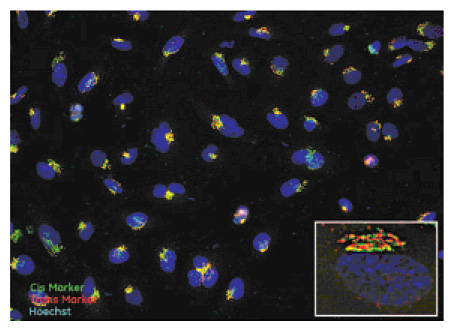
図1 薬剤未処理のHeLa細胞におけるシスゴルジ局在GM130(緑)とTGN局在TGN46(赤)のマーカーの局在性を示しています。画像はIN Cell Analyzer 2000で20×/0.45 NA対物レンズと2Dデコンボリューションモードを用いて取得しました。挿入画像:100×/0.9 NA対物レンズと三次元デコンボリューションモードを用いて取得した画像。
マテリアル
使用した製品
IN Cell Analyzer 2000 Standard Chip
CCDカメラ (28953463)
IN Cell Investigator, Single Seat License* (28408971)
*本アプリケーションでは、ソフトウェアバージョン1.5を用いました。
ユニットは研究用のみです。
必要なその他のマテリアル
HeLa Cells ATCC
Dulbecco's Modified
Eagle's Medium(DMEM) Sigma, D6546
Fetal bovine serum JHR Biosciences, 12103
L-Glutamine 200 mM solution Sigma, G7513
Penicillin-streptomycin, 100× Invitrogen, 15070-063
Nocodozole Sigma, M1404
Brefeldin A(BFA) Sigma, B7651
DMSO Sigma, D2650
Formalin solution* Sigma, HT50-1-2
PBS Sigma, D8537
BSA 10% Invitrogen, P2489
Triton X-100* Sigma, T8787
TGN-38 primary antibody, rabbit
polyclonal IgG (200 μg/ml) Santa Cruz, sc-33783
Chicken anti-rabbit Texas Red™ secondary
antibody (200 μg/0.5 ml) Santa Cruz, sc-3925
GM130 primary antibody,
goat polyclonal IgG (200 μg/ml) Santa Cruz, sc-16268
Donkey anti-goat FITC secondary
antibody (200 μg/0.5 ml) Santa Cruz, sc-22024
Hoechst™ 33342 nuclear stain Molecular Probes, H3569
μClear plates, 96-well tissue
culture treated, black Greiner™ Bio One, 655090
*Triton X-100 and formalin solution are classified as harmful. Handle in accordance with MSDS and local laboratory safety guidelines.
細胞増殖培地
ウシ胎仔血清(10% v/v)/Lグルタミン(2 mM)/ペニシリン-ストレプトマイシン(1% v/v)添加DMEM
実験方法
HeLa細胞を96 ウェルプレートに播種し、37°Cで一晩インキュベートしました。被験物質(ノコダゾールまたはBFA)を添加して4 時間インキュベートした後に、細胞を2 %ホルマリンで固定し、その後0.2 %トライトンX100 で処理しました。免疫染色では、一次抗体を各ウェルに添加して室温で1 時間インキュベートし、次に二次抗体を添加して室温でさらに 1 時間インキュベートしました。トランスゴルジ網(TGN)は、ウサギ抗TGN38 一次抗体(ヒトホモログTGN46 と交差反応する)に続きテキサスレッド(TR)標識トリ抗ウサギIgG を添加して検出しました。シスゴルジマーカーGM130 は、ヤギ抗GM130 一次抗体に続きFITC 標識ロバ抗ヤギIgG を添加して検出しました。細胞核はHoechst™ 33342 核染色色素により標識しました。
測定手順
- 96 ウェルプレートに1×105個/mL のHeLa 細胞を1 ウェルあたり100 μL播種し、37°Cで一晩インキュベートします。
- 薬剤溶液の調整。ノコダゾールは0~450 μM、BFAは0~200 μg/mLの濃度に細胞増殖培地で調製します。
- Z’値測定のためコントロールwellを調製します。培地を除去した複数のwellに20 μMノコダゾール100 μLまたは20 μg/mL BFA 100 μL添加します。
- 用量依存性を判定するために、薬剤を添加するwellから培地を除去しノコダゾールまたはBFAの滴定用液(ステップ2で調製)を100 μL添加して37°Cで4 時間インキュベートします。
- 全ウェルから培地を除去し、固定液(2 %ホルマリン)100 μLを添加して室温で15~20 分間インキュベートします
- 固定液を除去し、PBS 200 μLでウェルを2回洗浄します。
- 透過処理溶液(PBS中0.2 %トライトンX100)100 μLを添加し、室温で1 時間インキュベートします。
- 洗浄液(PBS中0.1 % BSA)とブロッキング溶液(PBS中1 % BSA)を調製します。
- 透過処理溶液を除去し、洗浄液200 μLで2回洗浄します。
- ブロッキング溶液100 μLを添加して室温で20 分間インキュベートします。
- ブロッキング溶液を除去し、洗浄液200 μLで洗浄します。
- 4°Cで保存していた一次抗体を取り出し、バイアルを穏やかに振盪し、微量遠心機で12,000 g×2 分間遠心して凝集塊を除去します。
- 希釈した一次抗体100 μLをウェルに添加した後、室温で1 時間インキュベートします。
- 一次抗体溶液を吸引した後、洗浄液200 μLで3 回洗浄します。
- 4°Cで保存していた二次抗体を取り出し、バイアルを穏やかに振盪し、微量遠心機で12,000 g×2 分間遠心します。
- 希釈した二次抗体100 μLをウェルに添加した後、室温で1 時間インキュベートします。
- 二次抗体混合液を吸引した後、洗浄液200 μLで3 回洗浄します。
- PBSを用いて8 μM Hoechst™ 33342核色素を調製します。各ウェルに100 μL添加し、室温で15 分間インキュベートします。
- Hoechst™ 33342を吸引し、PBS 200 μLで2 回洗浄します。
- PBS 200 μLを添加したウェルを黒いプレートシールで覆い保存します。
解析プロトコール
視野全体および細胞毎の変化を数値化するために、Investigator1.5 に含まれるDeveloper Toolbox を用いて画像解析を行い、細胞数、核の形態、様々なゴルジ体パラメータに対する化合物の影響をグラフ化しました(図5)
結果
20×対物レンズによる画像は、シスゴルジとトランスゴルジの典型的な局在性を示し、リボン状の構造体として近接して現れます(図1)。2つのマーカーが重複せずに局在していることは、高倍率の対物レンズを用いて3Dデコンボリューションモードで細胞画像を取得するとより明らかです(図1 、挿入画像)。ゴルジマーカーの表現型は、ゴルジの面積や長さ、蛍光強度やゴルジのカウント数を用いて数値化することができます(6)。
BFAはメンブラントラフィッキングに関与するグアニンヌクレオチド交換因子を阻害し、コンパートメントマーカーの局在性に異なる影響を与えるため、ゴルジ体の分析に汎用されます。文献報告(7, 8)と同様に、BFA処理後、ゴルジ体の構造タンパク質GM130 は点状のフラグメントに局在しますが、TGN マーカーは明らかに異なる局在パターンを示し、シグナルが細胞質全体により広く分散するか、もしくは微小管形成中心領域の核近傍の小胞に集積します(図2)。
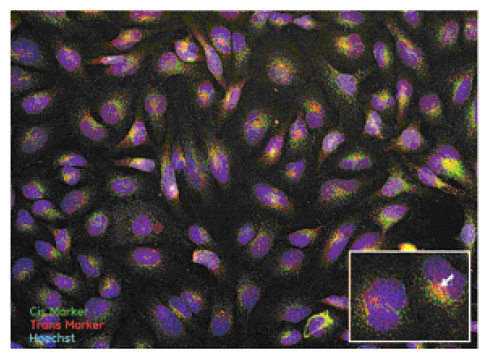
図2 20 μg/mL BFAで処理したHeLa細胞内のシスゴルジマーカーとTGNマーカーの局在性。20×/0.45 NA対物レンズを用い二次元デコンボリューションの画像モードで取得した核(青)、シスゴルジGM130(緑)、TGN46(赤)チャネルの融合画像の疑似カラー画像。挿入画像:40×/0.6 NA対物レンズを用いて二次元デコンボリューションの画像モードで取得したトリミング画像。白矢印はTGN46(赤)の核近傍への局在性を示します。
微小管重合を阻害するノコダゾールは、ゴルジ体の分散を生じさせます(9)。図3と図4は、ノコダゾールの作用により生じた分散したゴルジ内のシスゴルジマーカーとTGNマーカーの局在性を示します。
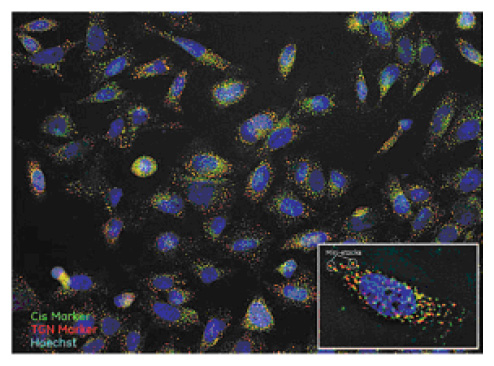
図3 分散したゴルジ体の別々の領域へのシスゴルジマーカーとTGNマーカーの局在。HeLa細胞を1.85 μMノコダゾールで処理した後、核(青)、GM130(緑)、TGN46(赤)を染色しました。画像取得条件は図2と同一です。挿入画像:100×/0.9 NA対物レンズを用いて三次元デコンボリューションの画像モードで取得したトリミング画像。分散例を白い円で囲みました。
ノコダゾール処理細胞でみられる断片化パターンはシスゴルジマーカーとTGNマーカーで類似していますが、局在分析(図4)では、マーカーは別々の部位に分布することを示しています(シスゴルジとトランスゴルジの共局在は60 %未満)。
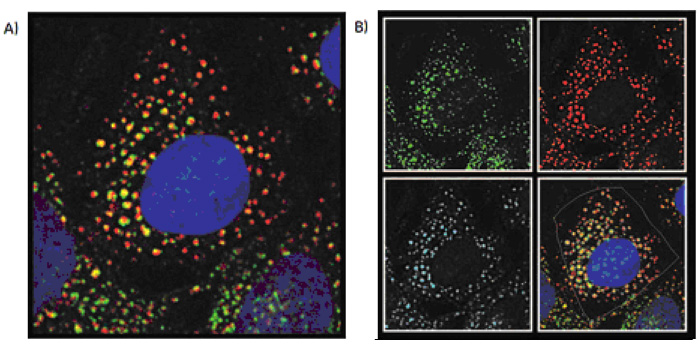
図4 ノコダゾール処理後のシスゴルジマーカーとTGNマーカーの共存分析。(A)40×/0.6 NA対物レンズを用いて二次元デコンボリューションの画像モードで取得した画像。HeLa細胞を1.85 μMノコダゾールで処理した後、核(青)、GM130(緑)、TGN46(赤)を染色しました。(B)シスゴルジ(緑オーバーレイ)、TGN(赤オーバーレイ)、マーカー重複領域(青緑オーバーレイ)、細胞体(黄色オーバーレイ)と確認される領域を示しています。
ノコダゾールとBFAの表現型への影響を比較するために、様々な解析パラメータについて検討し、変化の大きい9種類のパラメーターを図5に示しました。結果は、BFA濃度の上昇に伴い細胞数と核面積がいずれも減少することを示しています。これは、BFA誘発性の小胞体(ER)-ゴルジ体間小胞輸送の阻害によりアポトーシスに至るという報告(2)に一致しています。これらの影響はノコダゾール処理細胞ではみられず、僅かながら上昇傾向にあります。
用量依存性実験におけるシスゴルジマーカーとTGNマーカーが結合する小胞数のプロット(図5)は、図2と図3の画像結果と一致し、2種類の薬剤の異なる影響を示しています。ノコダゾール処理細胞では、シスゴルジマーカーとTGNマーカーの小胞数はいずれも増加します(図5A)。一方、細胞をBFAで処理すると、シスゴルジマーカーの小胞数は用量と共に増加しますが、TGNマーカーの小胞数は大きな変化はみられません(図5B)。
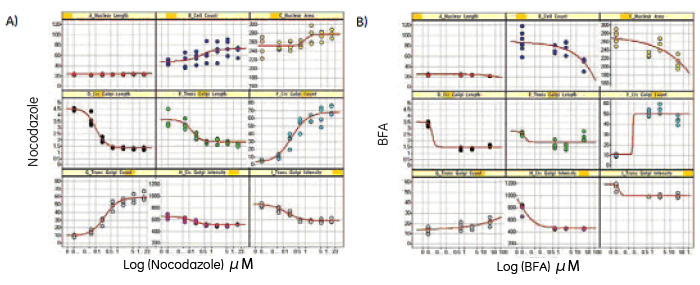
図5 9種類の細胞パラメータに対する(A)ノコダゾールおよび(B)BFAの影響。図は、IN Cell Investigatorに搭載されるSpotfire DecisionSite™ソフトウェアを用いて作成しました。
ノコダゾール処理をポジティブコントロール、未処理をネガティブコントロールとして、スクリーニングアッセイを開発しました。96ウェルプレートを用いて各処理条件(N=32)で実験を行いZ'値(10)を算出しアッセイ系の評価しました(図6)。処理および未処理の細胞郡に対する1細胞あたりのシスゴルジマーカーとTGNマーカー小胞数の分布はいずれもZ’値 0.5を超える再現性の高いデータを示し、アッセイはスクリーニング系として十分であることを示しました。
この実験系はシスゴルジマーカーとTGNマーカーに影響を持つノコダゾールと類似の性質を持つ化合物のスクリーニングに利用できます。(図7)。
シスゴルジとTGNの小胞数の比(localization index)を用い両者の局在の関係を解析しました。Localization index=[(トランスゴルジ数+シスゴルジ数)/2]/(トランスゴルジ数/シスゴルジ数)。ノコダゾールのlocalization indexの平均値は127でしたが、2つのマーカーの局在性に対して異なる効果を示すBFAのlocalization indexの平均値は46でした。
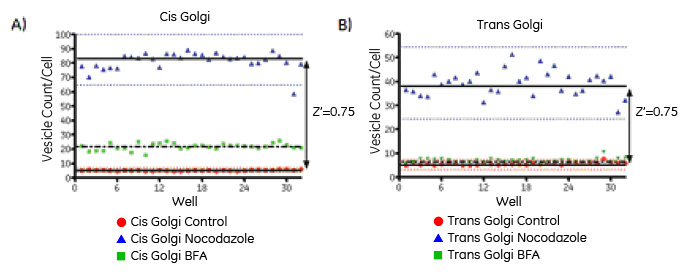
図6 Z'値を用いたスクリーニング系の性能評価。未処理のネガティブコントロール(赤)、ノコダゾール処理のポジティブコントロール(青)、被験物質のBFA(緑)について細胞あたりの平均小胞数をウェル番号に対してプロットしています。点はウェルあたり4視野の解析から得た各複製ウェルの平均値を示します。青と赤の点線は平均値±3 SDを表します。実線はポジティブおよびネガティブコントロール(n=32ウェル)の平均値を示します。黒の破線はBFA処理(n=32ウェル)の平均値を示します。(A)GM130(シスゴルジマーカー)分布の解析から得た結果、(B)TGN46(TGNマーカー)分布の解析から得た結果。
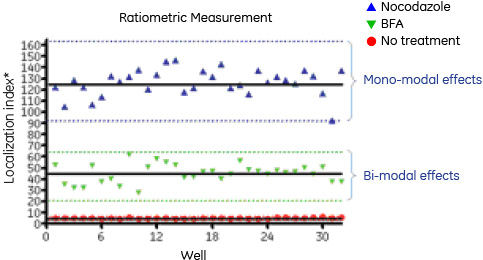
図7 TGNおよびシスゴルジ領域への薬剤処理の比率測定。本文に記述したように、localization indexはTGNマーカーとシスゴルジマーカーの小胞数の比のより算出しました。各データは同一ウェルから取得した4視野の画像から得ました。黒の実線はN=32から得られた平均値を示します。点線はそれぞれの平均値±3 SDを表します。青三角:ノコダゾールポジティブコントロールウェル(平均値=127、STD=12)、赤丸:未処理ネガティブコントロールウェル(平均値=5.0、STD=0.47)、緑三角:BFA処理ウェル(平均値=45、STD=8.2)。
まとめ
ゴルジ体の形態変化の定量にはハイコンテンツアナリシス技術が必要とされます。IN Cell Analyzer 2000を用いることにより、シスゴルジコンパートメントとTGNコンパートメントを区別するために十分な品質の画像を得ることができました。また、三次元デコンボリューション技術は、このような小さい構造体をより鮮明にすることを可能とし、画像解析結果の向上につながります。今回のようなコンパートメントマーカーの個別または組み合わせによる解析は、シスゴルジとTGNコンパートメント表現型への特異的作用を持つ化合物スクリーニングに利用できます。
References
- Hicks, S. W. and Machamer, C. Golgi structure in stress sensing and apoptosis. Biochim. Biophys. Acta. 1744(3), 406-14 (2005).
- Wlodkowic, D. et al; ER-Golgi network - A future target for anti-cancer therapy. Leukemia Research 33, 1440-1447 (2009).
- Cole, N.B. and Lippincott-Schwartz, J. Organization of organelles and membrane traffic by microtubules. Curr. Opin. Cell Biol. 7, 55-64 (1995).
- Hong Zhang et al. Nocodazole-induced p53-dependent c-Jun N-terminal Kinase Activation Reduces Apoptosis in Human Colon Carcinoma HCT116 Cells. J. Biol. Chem. 277, 43648-43658 (2002).
- Wallace, W, et al. A Working person’s Guide to Deconvolution in Light Microscopy. BioTechniques 31, 1076-1097 (2001).
- Liebel, U. et al. A Microscope-based screening platform for large-scale functional protein analysis in intact cells. FEBS letters 394-398 (2003).
- Seeman, J. et al. Matrix proteins can generate the higher order architecture of the Golgi apparatus. Nature 407, 1022-1025 (2000).
- Holloway, Z. G. et al. Activation of ADP-ribosylation factor regulates biogenesis of the ATP7A-containing trans-Golgi network compartment and its Cu-induced trafficking. Am. J. Physiol. Cell Physiol. 293, C1753-C1767 (2007).
- Cole, N. B. et al. Golgi dispersal during microtubule disruption: regeneration of Golgi stacks at peripheral endoplasmic reticulum exit sites. Mol. Biol. Cell 7, 631-650 (1996).
- Zhang, D. H. A pair of new statistical parameters for quality control in RNA interference high-throughput screening assays. Genomics 89(4), 552-561 (2007).
- Drecktrah, D. et al. Phospholipase A2 Antagonists Inhibit Nocodazole-indused Golgi Ministack Formation: Evidence of an ER Intermediate and Constitutive Cycling. Mol Biol. Cell 10, 4021-4032 (1999).








