
印刷用PDF
Oris Pro Cell Migration and Invasion Assaysによる細胞遊走アッセイ
はじめに
細胞の遊走と浸潤は、創傷治癒やガン細胞の転移といった生理学的、病理学的プロセスにおいて重要な役割を果たします[1]。これらのプロセスには、新規治療方法の開発に向けた新たなターゲット分子が関与する可能性があり、ハイスループットの化合物スクリーニングに適した生理学的なアッセイが求められます[2]。
The Oris Pro Cell Migration and Invasion Assays(Platypus Technologies)は、96ウェルプレートでCell exclusion assaysによる化合物スクリーニングを行うために有用なツールです。アッセイプレートの各ウェルの中央にはBiocompatible Gel(BCG)がスポットされており、播種した接着細胞が接着しないようになっています。細胞播種後にBCGは溶解され、ウェル中央の検出領域に向かって細胞の遊走がはじまります(図1)。細胞の動きは、本稿で示すようにプレート底面で2次元に展開されます。
IN Cell Analyzer 2000は2048×2048 pixelラージCCDを搭載し、2次元の遊走アッセイを行なううえで有効です。2×、4×レンズを用いることで、7.6 mm四方(2×)、3.8mm四方(4×)の視野サイズで細胞個々がカウントできる程度の解像度が得られます。96ウェルプレートのウェルサイズに対して、2×レンズでホールウェル、4×レンズで70%以上をカバーし、少ない視野数で測定が行えるため、スループットが向上します(図2)。
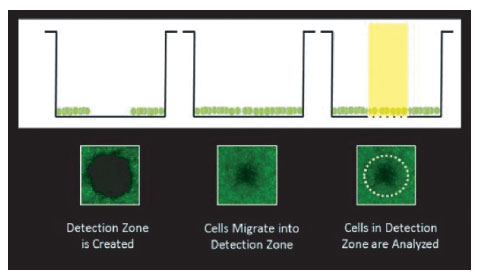
図1 Oris Pro Cell Migration and Invasion Assays

図2 96ウェルプレートの1ウェルに対するIN Cell Analyzer 2000(large CCD)の視野サイズ
96ウェルプレートの1ウェル(赤)に対して、青い四角が2×レンズ、黄色い四角が4×レンズの視野サイズです。
実験内容
サンプルおよび試薬
The Oris Pro Cell Migration and Invasion Assays(Platypus Technologies)
Human umbilical vein endothelial cells(HUVEC)
Cytochalasin D
TRITC-phalloidin
DAPI
方法
Collagen I を塗布したOris Pro platesに対してHuman umbilical vein endothelial cells(HUVEC)を各ウェル 25,000細胞播種しました。1時間後、アクチン重合阻害剤Cytochalasin D(0.0078μM ~2μM)およびコントロールとして0.1%DMSOを含む培地に置換しました。18時間インキュベーションの後、0.25% glutaraldehydeで15分固定し、0.1% Triton-X 100で膜透過処理、TRITC-phalloidinおよびDAPIで染色しました。IN Cell Analyzer 2000により4×レンズで各ウェル1視野ずつ測定しました(図3)。
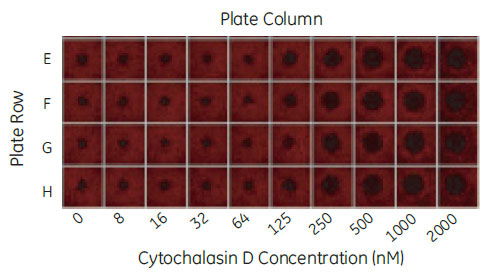
図3 4×レンズによるサムネイル画像
96ウェルプレートのE-F 列。TRITC-phalloidin 染色画像。
結果
IN Cell Investigatorソフトウェアにより、様々な解析を試みました。はじめに、視野全体の細胞数や細胞カバー率を解析しました。続いて、2μM Cytochalasin D 処理したウェルについて、遊走が生じる前の画像から細胞のいない検出領域を設定し、各画像における検出領域内の細胞数や細胞カバー率を解析しました(図4、5)。表1が示すように、視野全体の細胞数(Count of Nuclei)を除いて、全ての解析オプションでZスコアは0.5を上回りました。検出領域を指定した解析では、視野全体の解析結果に比べZスコアが大きく上昇しています。IN Cell Investigator softwareでは、これらのデータを一度の解析で算出し、最適な測定方法を検討することができます。
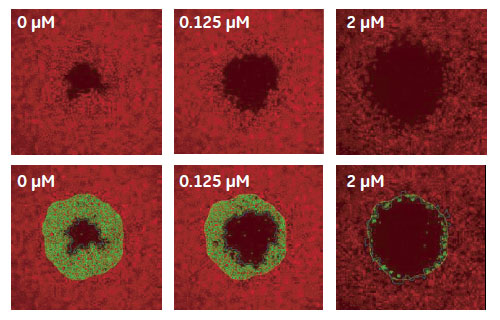
図4 Cytochalasin D 処理による細胞遊走への影響(TRITC-phalloidin 染色サンプル画像)
下段は検出領域を設定して解析した場合の画像認識の様子をオーバーレイしたものです。(黄ライン)リファレンスイメージによる検出領域、(緑ライン)検出領域中の細胞、(青ライン)細胞のいない領域。
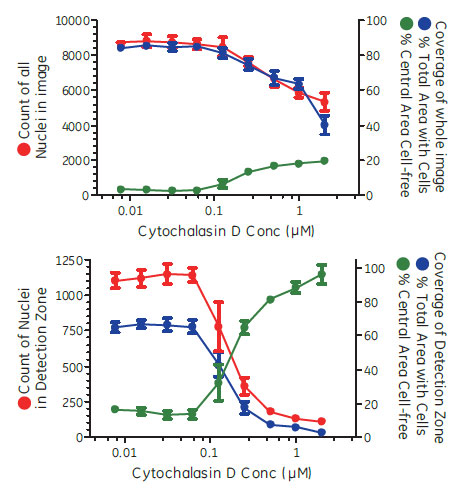
図5 視野全体による解析と検出領域を指定した解析における細胞遊走阻害解析結果の違い
(A)視野全体を対象にした解析結果。(B)検出領域のみを対象にした解析結果。細胞数(●)のデータはDAPIイメージから核数をカウントしました。細胞のカバー率(●)および細胞のいない領域割合(●)はTRITCイメージから算出しました。n=8、エラーバーはSDを示します。
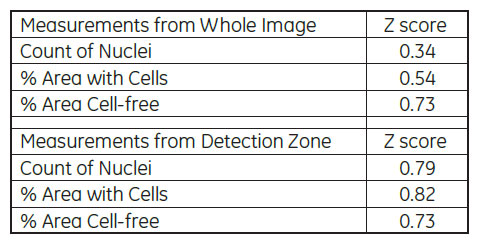
表1 視野全体による解析と検出領域を指定した解析におけるZスコアの比較
検出領域のみを対象にした解析結果の比較
ハイコンテントアナイシス(HCA)は、細胞アッセイから情報リッチなデータを得ることができます。DAPIによる核染色では細胞の数やポジションを測定するのみならず、個々の細胞の状態や細胞周期をモニターすることができます。図6ではCytochalasin DによるDNA含量および核の構造(蛍光強度(SD))への影響を比較しました。その結果、Cytochalasin DによりMitotic細胞の増加が見られました。
細胞遊走アッセイを画像ベースで行う利点は、このように細胞集団の様子が評価できることです。本アッセイでは、遊走を測定する検出領域の内外における細胞のサブポピュレーションを比較することもできます(図7)。核のテクスチャとDNA含量を比較したところ、検出領域の内側で細胞分裂が活発に起きている傾向が見られました(図8)。
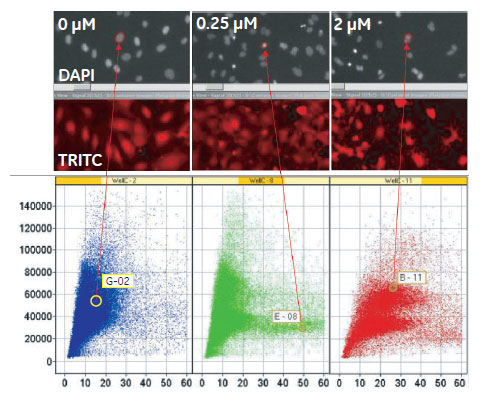
図6 Cytochalasin D処理によるDNA含量および核のテクスチャへの影響
(X軸)細胞核あたりの蛍光強度の標準偏差(核のテクスチャ)。(Y軸)細胞核あたりの蛍光強度×面積(DNA 含量)。左より0、0.25、2μM Cytochalasin D 処理。8ウェル分の反復試験データを一つのスキャッタープロットにまとめました。各プロットは画像とリンクし、対応する細胞のイメージが確認できます。
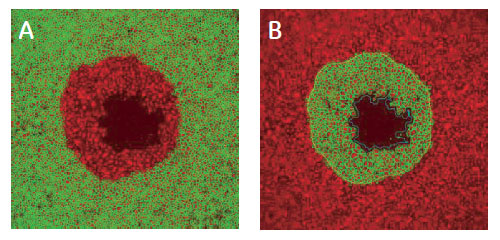
図7 細胞のサブポピュレーション解析
TRITC-phalloidin 標識細胞の画像。(A)検出領域外の認識。(B)検出領域内の認識。黄ラインは検出領域の境界線、緑ラインは各細胞の認識の様子を示します。
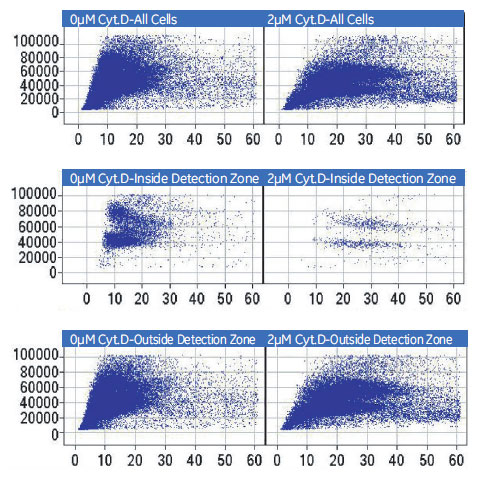
図8 各領域におけるCytochalasin DによるDNA含量および核のテクスチャへの影響
(X 軸)細胞核あたり蛍光強度の標準偏差(核のテクスチャ)。(Y 軸)細胞核あたりの蛍光強度×面積(DNA 含量)。(左)コントロール。(右)2μM Cytochalasin D処理。8ウェル分の反復試験データを一つのスキャッタープロットにまとめました。(上段)総細胞。(中段)検出領域内の細胞。(下段)検出領域外の細胞。
まとめ
- Oris Pro Cell Migration 96-well Assay plates を使用した、IN Cell Analyzer 2000ラージCCDシステムによる細胞遊走アッセイを行った結果、高いZスコアでの評価が可能でした。
- 4×(または2×レンズ)においても、細胞個々を解析するに十分な解像度であることが確認されました。
- IN Cell Investigator ソフトウェアにより視野全体または特定の検出領域のみを対象にした測定を一度に実施し、アッセイ方法の最適化が検討できます。
- 細胞遊走評価に併せて、DNA含量から細胞周期解析を行った結果、遊走している検出領域中の細胞において活発に細胞分裂を起こしている傾向が見られました。
リファレンス
- Ridley et al., 2003. Science. 302(5651):1704-1709.
- Carragher, 2009. Clin. Exp. Metastasis. 26:381-397.










