|
||
|---|---|---|
|
|
||
|
Location:Home > 実験手法別製品・技術情報 > セルラーサイエンス |
||
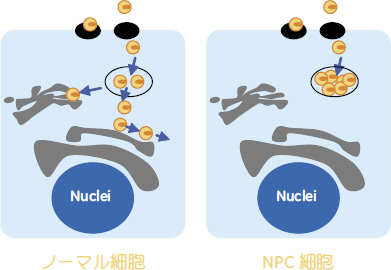
IN Cell Analyzer 1000を用いた脂質代謝解析細胞膜は複雑な脂質組成、分布をもち、その膜の構成そのものが細胞の機能に重要な役割を果たしています。近年特定の脂質が集積すること自体が細胞の機能に直結すると報告され、基礎研究や創薬の現場で脂質代謝解析への関心が高まっています。しかしながら、難水溶性の脂質は実験材料として取り扱いが難しく、脂質を対象とした薬剤のハイスループットスクリーニングは組みにくいのが実情でした。本報では、脂質特異的な蛍光色素や毒素をイメージングサイトメーターIN Cell Analyzerと組み合わせることで、脂質に対する薬剤のハイスループットスクリーニングに成功した2つの事例をご紹介します。 1.ニーマン-ピック細胞を用いたコレステロール蓄積阻害剤のスクリーニングニーマン-ピック病(Niemann-Pick病)は細胞内にコレステロールが蓄積してしまう病気で、それぞれに原因や病状の異なるA~E型が存在しています。このうちコレステロール蓄積のメカニズムが最も分かっていないニーマン-ピック病C型患者由来の細胞(NPC細胞)では、細胞内の脂質輸送がうまく働かず、NPC1遺伝子の欠損が主な原因として報告されています。NPC1は細胞外や細胞表面から取り込んだコレステロールや糖脂質をエンドソームやライソゾームに運ぶ小胞に存在すると考えられており、NPC1欠損の結果として、エンドソームにコレステロールや複合糖脂質が蓄積します。今回はこのNPC細胞を対象に選び、NPC細胞におけるコレステロール蓄積阻害剤の探索を行いました。
使用した製品
細胞
その他の試薬
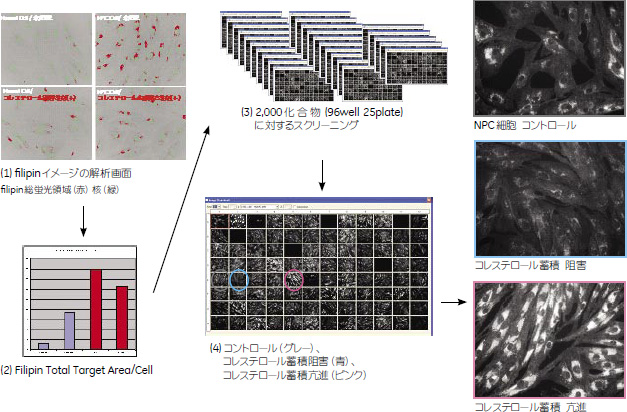
実験方法NPC細胞 4x103 Cells/wellの密度で96ウェルプレートに播種して薬剤(2,000化合物)存在下で2日間培養後、図2の手順に従い細胞固定、コレステロール特異的に結合する色素であるfilipin、核染色色素であるTOPRO-3による染色を行いました。 つづいてIN Cell Analyzer 1000を用いて細胞イメージを撮り込み、以下のパラメーターにおける比較解析を行いました。 視野内のfilipinの総蛍光領域(赤点の領域)/ 核数
結果まずコントロール条件検討の結果、取り込まれたfilipinによる蛍光シグナルがNormal Cellに比較しNormal Cell+薬剤誘導では3倍、NPC Cell では7倍に増幅していることを確かめ、この実験系がスクリーニングの評価系として適用可能であることを確認しました。続いて、2,000化合物を対象にコレステロール蓄積阻害剤のスクリーニングを実施し、IN Cell Analyzer 1000を用いた解析の結果、(1)NPC細胞においてコレステロール蓄積を減少させる化合物、(2)NPC細胞もしくは健常者の細胞において、コレステロールを蓄積させる化合物、以上2種類の化合物を同定しました。
2.スフィンゴミエリン特異的毒素:ライセニン耐性薬剤のスクリーニング目的ライセニンはシマミミズの体腔液から分泌される分子量41 kDaの蛋白質です。ライセニンは細胞膜の構成燐脂質のうち、スフィンゴミエリン(SM)に特異的に結合し、膜の構造と透過性の変化をもたらします。血管平滑筋収縮作用、心筋の陽性変力・陽性変時(収縮力と心拍数の増加)作用があり、赤血球の溶血・細胞死を引き起こすことが知られています。今回の研究ではこのライセニンに対する毒性耐性薬剤のスクリーニングを行いました。
使用した製品
細胞
その他の試薬
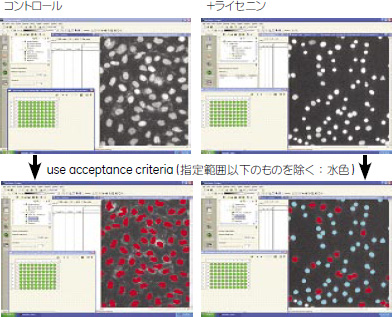
実験方法CHO細胞を3x104 Cells/wellの密度で96 well plateに藩種して薬剤(2,000化合物)存在下で2日間培養しました。2日後200 ng/mlライセニンで30 min処理し、図5のフローに従い細胞固定、BODIPY-C5-PC、DAPIによる染色を行いIN Cell Analyzer 1000を用いて細胞イメージを撮りこみました(3視野/well)。 ライセニンを投与すると細胞膜構造と透過性が変化し、結果として細胞、核の収縮が観察されます。今回は膜構造の変化を検出するためにBODIPY-C5-PC、核構造の変化を検出するためにDAPIによる染色を行いました。一次スクリーニングはライセニンに対する細胞毒性について、核の収縮を指標に判定を行いました。IN Cell Analyzer Developerソフトウェアにより、Nuclear Area > 85 μm2という閾値を設定し、指定範囲以下の核についてはカウントから除外しました(図6の水色選択核)。そして核が収縮していない赤色で選択された細胞数(= 生細胞数)を算出しました。
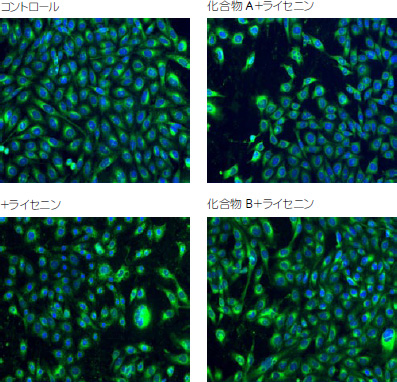
結果IN Cell Analyzer 1000を用いた細胞スクリーニングの結果、コントロールに対し50%<の生細胞数を保有するwellをピックアップし、2,000化合物から20化合物の候補を絞り込みました。ネガティブコントロールの生細胞数を100%とし各プレートごとに補正をかけています(図7)。 つづいて絞り込まれた20化合物について細胞イメージを確認しコントロールと同程度の細胞形状を維持する化合物を同定しました(図8)。今後は、SM合成過程の阻害剤やSMの前駆体を用いて同定された化合物のライセニン毒性阻害機構の解明を進めていく予定です。
サンプルデータご提供独立行政法人 理化学研究所 お問合せフォーム※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。 お問い合わせありがとうございます。 |
||
© 2025 Cytiva