
|
|||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||
|
Location:Home > 実験手法別製品・技術情報 > タンパク質サンプル調製・前処理 |
|||||||||||||||||||||||||||||||||||||||||||||||
第2章
|
|||||||||||||||||||||||||||||||||||||||||||||||
| アッセイ法 | 内容 | 利点 | 欠点 |
|---|---|---|---|
| 紫外吸収法 | 280 nm付近に吸光のあるトリプトファン、チロシン、フェニルアラニンの吸光度を測定し定量を行います。 | 簡単で、サンプルを破壊しない。 | 非タンパク質のバックグラウンドによる影響がある。 |
| ブラッドフォード法 (19) | CBBG-250色素をタンパク質と結合させてその吸収波長595 nm付近を測定します。 | 速くて、高感度。 | 界面活性剤の定量への影響がある。 |
| ビシンコニン酸法 (BCA) | ペプチド結合に反応させた銅イオンをBCAと反応させ、その吸収ピーク562 nm付近を測定します。 | 高感度で界面活性剤の影響を受けにくい。 | 還元剤やEDTAの定量への影響がある。 |
| 2-D Quant Kit | タンパク質と銅イオンの結合を利用したもので、非結合銅イオンの量と比色試薬とを反応させることで、480 nm付近の吸収ピークを測定しタンパク質定量を行います。 | 界面活性剤還元剤、Ureaなどの影響を受けずに定量可能です。 | 操作時間がかかる。 |
2-D Quant Kitを用いた苛酷条件の溶液中のタンパク質濃度測定
Cytivaの2-D Quant Kitは、二次元電気泳動、SDS-PAGE、IEFなど分離能が高い電気泳動手法を用いるサンプル中のタンパク質濃度を正確に測定できるように設計されています。このような手法のサンプル調製に使用される試薬の多く(界面活性剤、還元剤、カオトロープ、両性担体など)は多くのタンパク質定量アッセイに影響を与えます。2-D Quant Kitを用いた手順では、タンパク質が定量的に沈殿し干渉しうる物質は溶液中に残ります。このアッセイは、銅イオンとタンパク質の特異的結合に基づいています。沈殿したタンパク質を銅含有溶液に再懸濁し、比色剤を用いて結合していない銅を測定します。呈色強度はタンパク質濃度と逆相関します。このアッセイは0~50 μgの範囲のタンパク質量で線形反応を示します。
この方法は、2% SDS、1% DTT、8 Mチオウレア、4% CHAPS、2% ファルマライトおよび2% IPG Bufferなどの一般的なサンプル調製試薬の影響を受けません。
タンパク質定量に現在使用されている分光測定法には、CBB色素との結合(参考文献19のBradfordの論文を参照してください)、またはタンパク質が触媒する銅二価イオン(Cu2+)から銅一価イオン(Cu+)への還元が利用されています (20-22)。色素結合アッセイは、CBB色素とも結合する試薬の存在下では使用できません。このような試薬には、ファルマライト、IPG Bufferなどの両性担体や、CHAPS、SDS、Triton X-100などの界面活性剤が挙げられます。銅二価イオンの還元に基づくアッセイは、DTTなどの還元剤の存在下や銅二価イオンと複合体を形成するチオウレアやEDTAなどの試薬の存在下では使用できません。
材料
キットに付属の沈殿剤、共沈剤、銅溶液、発色試薬A、発色試薬BおよびBSA標準溶液
2 mlの微量遠心チューブ
ボルテックスミキサー
微量遠心機
可視光分光光度計
前調製
発色試薬Aと発色試薬Bを100:1の割合で混合して適切な容量のワーキング発色試薬を調製します。1回のアッセイに1 mlのワーキング発色試薬が必要です。
ワーキング発色試薬は4~8℃で保管し、480 nmにおける吸光度(A480)が0.025未満であることを条件に1週間後まで使用できます。
プロトコール
詳しいプロトコールについては、キットの使用説明書を参照してください。
- 検量線を作成します。
- 6本のチューブにBSA標準溶液(2 mg/ml)を入れ、BSAの最終的な量が0 μg(ブランク)、10、20、30、40および50 μgとなるようにします。
- サンプルを調製します。
- 分析するサンプル1~50 μlを別々のチューブに入れます。
- 使用説明書に従って分光測定用サンプルを調製します。
- 水を基準として各サンプルと標準溶液の480 nmにおける吸光度を測定します。吸光度はワーキング発色試薬を添加してから40分以内に測定します。
- 標準溶液の吸光度をタンパク質量に対してプロットし、検量線を作成します。この検量線を使用してサンプルのタンパク質濃度を求めます。
注:他の大半のアッセイとは異なり、タンパク質濃度が高くなるにつれ溶液の吸光度は低下します。サンプルの値からブランクの値を引かないでください。また、ブランクの値を基準として使用しないでください。
2-D Quant Kitは、表2.9に示した物質の存在下でタンパク質を正確に定量するために使用できます。典型的な検量線を図2.6に示します。
表2.9 2-D Quant Kitとの適合性が確認されている化合物
| Compound tested | Concentration |
|---|---|
| SDS | 2% (w/v) |
| CHAPS | 4% (w/v) |
| Triton X-100 | 1% (w/v) |
| Pharmalyte™ pH 3-10 | 2% (v/v) |
| IPG Buffer pH 3-10 NL | 2% (v/v) |
| Tris | 50 mM |
| EDTA | 10 mM |
| DTT | 1% (65 mM) |
| β-Mercaptoethanol | 2% (v/v) |
| Urea | 8 M |
| Thiourea | 2 M |
| Glycerol | 30% (w/v) |
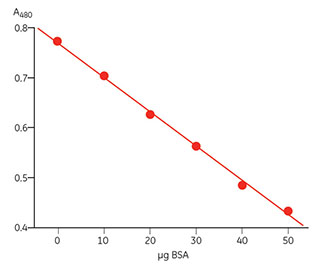
図2.7 2-D Quant Kitの典型的な検量線
お問合せフォーム
※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。
お問い合わせありがとうございます。
後ほど担当者よりご連絡させていただきます。
© 2026 Cytiva
