第3章
目的タンパク質の検出性改善(2)
タンパク質分画
ここで使用する定義では、タンパク質分画とは、可溶化した初期精製段階のタンパク質集団をタンパク質の非特異的な化学的/物理的特性(サイズ、電荷分布、pI、疎水性、溶解性など)の差に基づいて複数のサブサンプル/画分に分割するために使用する手順全体を指します。手順を調整することで、変性条件と非変性条件の両方を扱えます。多くの場合、選択性を補完し合うようにいくつかの操作を組み合わせて実施します。タンパク質分画は主として次の2つの方法で使用できます。
- 仮説に基づいて焦点を絞った初期タンパク質集団の分析:例えば高分子タンパク質を血漿から除去した後に、1つまたは少数の画分のみを分析します。この手法は、そのストラテジーとして、血漿中の高存在量タンパク質の大半は高分子量(Mr > 60 000)であるという事実と、バイオマーカーとなりうるタンパク質の大半は低分子量であるという仮説に基づいています。
- 初期タンパク質集団の網羅的分析:すべてのタンパク質が目的物質となる可能性がある場合、一般に多数の画分を生成して分析します。
タンパク質分画手法の選択肢には次のものがあります (2-7) 。
- 分画沈殿法(例:2-D Fractionation Kitを使用。後述。)
- クロマトグラフィー法(例:IEX、GF、クロマトフォーカシング、RPC、HIC)
- 分子量に基づくカットオフフィルター(例:UF)
- 一次元電気泳動
- フリーフロー等電点電気泳動
- ディファレンシャル界面活性剤分画(タンパク質の溶解性に基づく)
タンパク質沈殿法全般については第4章で説明します。ここでは、分画手法としてのタンパク質沈殿法の使用について説明します。Cytivaの2-D Fractionation Kitは、タンパク質分子の特性を利用し、溶媒のパラメーター(例:イオン強度、pH、温度)の変化によってタンパク質を沈殿します。溶解性の違いに基づいて一連のタンパク質画分が生成されるように溶媒のパラメーターを段階的に変化させます。分画されたタンパク質は、二次元電気泳動またはMS解析に適しています。
2-D Fractionation Kitを用いたタンパク質分画の例を図3.2に示します。この方法では、まずサンプルを可溶性画分と不溶性画分に分画します。可溶性画分をさらに分画します。このキットは、7画分を生成するプロトコールに合わせて最適化されています。プロトコールの要約を以下に示しますが、ユーザのニーズに合わせてプロトコールを最適化することも可能です。詳細については製品添付のマニュアルを参照してください。
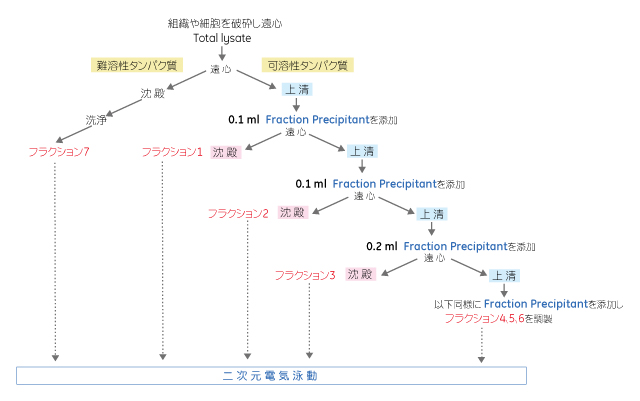
図3.2 2-D Fractionation Kitを用いたタンパク質分画の概略図
材料
キットに付属のLysisバッファー、画分沈殿剤、沈殿剤、共沈剤、洗浄バッファー、可溶化剤および希釈用液
前調製
- 洗浄バッファーを使用前に1~2時間、-20℃に冷却します。
- Lysisバッファーを氷中で冷却します。
- 画分沈殿剤の中に結晶が見える場合はボトルを加温します。
- 希釈用液を分注し、可溶化剤粉末を加えて可溶化剤溶液を調製します。各分析に必要な量だけを調製します。
プロトコール
- 0℃~4℃のLysisバッファー中で細胞または組織を超音波処理し、細胞を溶解します。
- 4℃で20,000 × gで30分間遠心分離し不溶性タンパク質をペレット化します。
- 上清を別のチューブに移します。
- 残りのペレットについてステップ1と2を繰り返します。その上清をステップ3の上清と合わせます。チューブに「可溶性タンパク質画分」と表示します。
- ペレットを洗浄します。ペレットの入ったチューブに「不溶性タンパク質画分」と表示します。
- 沈殿法で可溶性タンパク質画分を処理します。6つの画分が生成されます。詳細については製品添付のマニュアルを参照してください。
- キットの使用説明書に従って不溶性タンパク質画分を可溶化剤中で処理します。
クロマトグラフィーに基づく分画
IEX、GFまたはRPCを用いた小スケールのタンパク質分画は、シリンジを用いて手動で行うか(使用バッファーを段階的に変えます)、流量と濃度勾配を正確に制御でき、高い再現性をもつCytivaのÄKTA™microなどのクロマトグラフィーシステムを用いて行います。このクロマトグラフィーシステムにはスケールに合わせてさまざまな充填済みカラムを使用できます。これらの手法については他のハンドブックで扱っていますので、ここでは詳述しません。培養細胞から抽出したタンパク質の分画の例を図3.3に示します。この例では、IEXで得られた画分をトリプシンで消化した後、Nano-LC-MS/MSでタンパク質の同定を行いました(データ未掲載)。
カラム: Mono Q™ PC 1.6/5
サンプル: 未処理のリンパ管内皮細胞株(コントロール細胞)、または血管内皮増殖因子A(VEGF-A)か血管内皮成長因子C(VEGF-C)で処理したリンパ管内皮細胞株から得た全タンパク質抽出液
バッファーA: 20 mM塩酸トリス、8 M尿素、6%イソプロパノール、pH 8.0
バッファーB: バッファーA + 1 M NaCl
流量: 0.2 ml/分
勾配: 線形塩勾配、0%~50% B
検出: UV 215 nmおよびUV 280 nm
システム: ÄKTA™micro
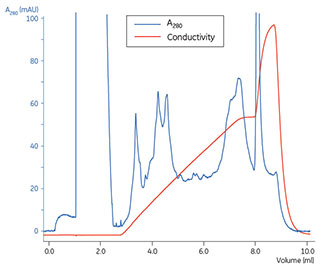
図3.3 Mono Q™ PC 1.6/5カラムを搭載したÄKTA™microシステムを用いてVEGF-A処理細胞から調製した全タンパク質抽出液の強陰イオン交換クロマトグラフィー(AIEX)で得られたクロマトグラム。コントロール細胞とVEGF-C処理細胞の前分画に関するデータはここには示しません。分離プロセス全体を通して画分を0.4 mlずつ採取しました。
>>目的タンパク質の検出性改善(3)
タンパク質サンプル調製ハンドブック目次 |3章 References | 略号と用語、記号解説

