
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Location:Home > 実験手法別製品・技術情報 > タンパク質サンプル調製・前処理 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
第3章
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Product | Mechanism | Suitable samples | Sample preparation format | Sample volume |
|---|---|---|---|---|
| NHS HP SpinTrap™ | アフィニティーリガンドの第一級アミンを介したカップリング | 細胞ライセート、血清、血漿 | SpinTrap™: Minispin columns (microcentrifuge) | 0.2-0.6 ml |
| NHS Mag Sepharose™ | Magnetic beads (MagRack 6) | 0.01-50 ml | ||
| HiTrap™ NHS- activated HP | HiTrap™: 1 and 5 ml columns (LC system or syringe) | > 0.5 ml | ||
| Streptavidin HP SpinTrap™ | ビオチン化生体分子を介したカップリング | 細胞ライセート、血清、血漿 | SpinTrap™: Minispin columns (microcentrifuge) | 0.2-0.6 ml |
| Streptavidin HP MultiTrap™ | MultiTrap™: 96-well plate (centrifugation) | 0.1-0.6 ml | ||
| HiTrap™ Streptavidin HP | HiTrap™: 1 and 5 ml columns (LC system or syringe) | > 0.5 ml | ||
| Protein A products1 | プロテインAへの抗体結合 | 血清、血漿、腹水、細胞培養上清 | SpinTrap™: Minispin columns (microcentrifuge) | 0.2-0.6 ml |
| MultiTrap™: 96-well plate (centrifugation) | 0.1-0.6 ml | |||
| Magnetic beads (Test tube, MagRack 6) | 0.01-50 ml | |||
| HiTrap™ Protein A HP | HiTrap™: 1 and 5 ml columns (LC system or syringe) | > 0.5 ml | ||
| Protein G products1 | プロテインGへの抗体結合 | 血清、血漿、腹水、細胞培養上清 | SpinTrap™: Minispin columns (microcentrifuge) | 0.2-0.6 ml |
| MultiTrap™: 96-well plate (centrifugation) | 0.1-0.6 ml | |||
| Magnetic beads (Test tube, MagRack 6) | 0.01-50 ml | |||
| HiTrap™ Protein G HP | HiTrap™: 1 and 5 ml columns (LC system or syringe) | > 0.5 ml | ||
| Immuno- precipitation Starter Pack | プロテインAまたはGへの抗体結合 | 血清、血漿、腹水、細胞培養上清 | Test tube (microcentrifuge) | 0.05-1.5 ml |
| Phos SpinTrap™ Fe | Fe3+ IMACによるリン酸化ペプチド濃縮 | リン酸化タンパク質の酵素消化 | Minispin columns (microcentrifuge) | 0.04-0.6 ml of diluted sample 1:1 |
| TiO2 Mag Sepharose™ | 金属酸化物アフィニティークロマトグラフィーによるリン酸化ペプチド濃縮 | リン酸化タンパク質の酵素消化 | Magnetic beads (test tube, MagRack 6) | 0.1-0.25 ml |
1 これらの製品はスモールスケールでの抗体精製(多量のイムノグロブリン)や選択した抗体を使用した免疫沈降に使用できます。
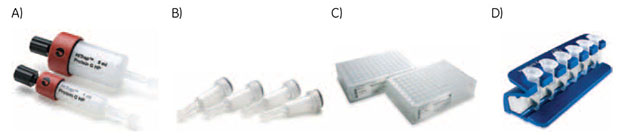
図3.6 HiTrap™カラム(A)、SpinTrap™カラム(B)、MultiTrap™プレート(C)、Mag Sepharose™磁気ビーズ(D)
HiTrap™カラムはシリンジ、ポンプ、またはÄKTA™microなどのクロマトグラフィーシステムで使用できます。表3.2にHiTrap™カラムの流量規格を要約します。
表3.2 HiTrap™カラムの流量
| Maximumflowrate1 | |
|---|---|
| 1 ml column | 4 ml/min |
| 5 ml column | 15-20 ml/min |
| Recommended flow rate2 | |
| 1 ml column | 0.2-1 ml/min |
| 5 ml column | 0.5-5 ml/min |
1 H2O at 25°C
2 クロマトグラフィーの手法によります。
最大圧は3 bar(43 psi、0.3 MPa)です。
HiTrap™製品の1つであるHiTrap™ Albumin & IgG Depletionカラムのプロトコールは、この章の前半の記述をご覧ください。
SpinTrap™カラムは標準的なラボ用微量遠心機に使用する設計となっています。
フタとボトムキャップはインキュベーションおよび溶出のステップで使用しますが、平衡化と洗浄のときには使用しません。遠心分離する前にボトムキャップを外し、ねじ式のフタをわずかにゆるめます(フタを約90°左に回します)。
インキュベーション前にカラムを上下反転させて混和し、担体を十分に懸濁させてしてください。インキュベーションは一般に室温で行います。ただし、ゆっくりと反応させるほうが好ましい場合には、室温よりも低い温度でインキュベーションを行っても構いません。
溶出ステップを行うときには、SpinTrap™カラムを手で反転させて混和します。
MultiTrap™プレートは比較的スループットが高い手法向けの96ウェルのプレートです。この製品は遠心分離または真空吸引に使用する設計となっており、ロボットシステムで使用できます。ただし、脱塩・バッファー交換用のPD MultiTrap™ G-25は遠心分離専用です。第5章でMultiTrap™プレートについて詳述します。
Mag Sepharose™磁気ビーズは、さまざまな機能を持つ磁気セファロースビーズです。このビーズは外部磁場でのみ磁性を持つため、遠心機やクロマトグラフィーシステムが必要なく、小スケールの実験にきわめて有用です。このビーズは親水性であるため、目的タンパク質との結合時、洗浄時および溶出時に水溶液中に容易に拡散します。ステップとステップの間に磁石でビーズに磁気を印加して、ビーズをチューブ壁に引き寄せます(図3.7を参照してください)。Protein A Mag Sepharose™ビーズまたはProtein G Mag Sepharose™ビーズを使用した抗体免疫沈降の例を以下に示します。

図3.7 磁石に近づけるとMag Sepharose™ビーズがチューブの壁に引き寄せられます(左)。磁石を外すとビーズが液中に拡散します(右)。
液除去ステップごとに、磁石を定位置にセットしたマグネットラックを使用してください。
液、洗浄バッファー、溶出バッファーなどを加える前に、磁石ラックから磁石を外してください。液を加えた後、微量遠心チューブをボルテックスするか手で反転混和してビーズを再懸濁させます。
複数のサンプルを処理する場合には、マグネットラックごと手で反転混和することをお勧めします。
インキュベーションステップでは、上下反転させるか、1.5 mlの微量遠心チューブに適した卓上シェーカーを使用してゲルビーズを十分に再懸濁し、溶液中にビーズが拡散した状態を維持してください。
目的タンパク質の分解を防ぐためにプロテアーゼ活性の阻害が必要となることがあります。CytivaではProtease Inhibitor Mixを提供しています(第2章第2回を参照してください)。
洗浄バッファーを使用する最後のステップでは、磁気ビーズ溶液を新しい微量遠心チューブに移します。この操作により、微量遠心チューブに非特異的に結合したタンパク質の溶出を防ぎます。
溶出後のサンプル分解を防ぐために、溶出画分を冷凍庫で保管するか、SDS-PAGEを行う場合にはサンプルバッファーを添加します。
お問合せフォーム
※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。
お問い合わせありがとうございます。
後ほど担当者よりご連絡させていただきます。
© 2026 Cytiva
