第3章
目的タンパク質の検出性改善(8)
アフィニティーベースのタンパク質濃縮およびタンパク質サブグループの濃縮(4)
リン酸化タンパク質およびリン酸化ペプチドの濃縮
リン酸化は、多くの基本的な調節に関与する翻訳後修飾です。リン酸化タンパク質およびリン酸化ペプチドは一般にきわめて低濃度で存在し、イオン化しにくいことから、MSによる検出は困難です。リン酸化タンパク質はリン酸化エピトープ特異的抗体を用いた免疫沈降で濃縮できます(第1章を参照してください。抗リン酸化チロシン[抗pTyr]抗体による免疫沈降を用い、Protein G Mag Sepharose™に架橋させてチロシンリン酸化タンパク質の濃縮を行った例を示しています)。
リン酸化ペプチドは一般に金属キレートまたは金属酸化物を使用して濃縮します。MOAC(Metal Oxide Affinity Chromatography)を使用した例を以下に示します。弊社のTiO2 Mag Sepharose™はリン酸化タンパク質ではなくリン酸化ペプチドの濃縮に用いる製品ですのでご注意ください。
TiO2 Mag Sepharose™を用いたリン酸化ペプチド濃縮のアプリケーション例
2種類のリン酸化タンパク質(α-カゼインおよびβ-カゼイン)と1種類の非リン酸化タンパク質(ウシ血清アルブミン[BSA])をTCEPで還元し、IAAでアルキル化した後、トリプシンで消化しました。各ペプチド50 pmolを含む100 μlの混液を調製し、1 × 500 μlの結合バッファー(1 Mグリコール酸、5% TFA、80% アセトニトリル)で平衡化を行ったビーズにこの混液を加えました。30分間結合させた後、ビーズを1 × 500 μlの結合バッファーと 2 × 500 μlの洗浄バッファー(1% TFA、80%アセトニトリル)で洗浄しました。2 × 50 μlの溶出バッファー(5%アンモニア)で溶出を行いました。溶出液を凍結乾燥させ、0.1%のトリフルオロ酢酸(TFA)を含む20%のアセトニトリル(20 μl)に溶解し、MALDI-ToF MSで分析しました(図3.9)。リン酸化ペプチドは濃縮され、非リン酸化ペプチドに対するリン酸化ペプチドの比は2.5となりました。
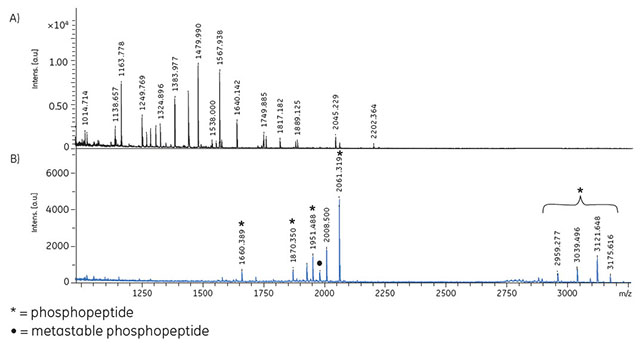
図3.9 TiO2 Mag Sepharose™で濃縮したトリプシン消化タンパク質混合物(BSA、α-カゼイン、β-カゼイン各50 pmol)のMALDI-ToF MS分析。
凍結乾燥した溶出液を溶解して20 μlとしてからスポットしました。出発サンプル(A)とTiO2 Mag Sepharose™からの溶出液(B)のスペクトルを示します。リン酸化ペプチド(*、●印)のみピークが検出され、リン酸化ペプチドが濃縮されたことが分かります。
>>目的タンパク質の検出性改善(9)
タンパク質サンプル調製ハンドブック目次 |3章 References | 略号と用語、記号解説

