
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Location:Home > 実験手法別製品・技術情報 > タンパク質サンプル調製・前処理 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
第5章
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Run order | pH | NaCl (mM) | Arginine conc. (M) |
|---|---|---|---|
| 1 | 3.5 | 375 | 0.5 |
| 2 | 4.0 | 750 | 0 |
| 3 | 3.0 | 750 | 0 |
| 4 | 4.0 | 0 | 1.0 |
| 5 | 3.5 | 375 | 0.5 |
| 6 | 3.0 | 0 | 0 |
| 7 | 4.0 | 0 | 0 |
| 8 | 4.0 | 750 | 1.0 |
| 9 | 3.5 | 375 | 0.5 |
| 10 | 3.0 | 750 | 1.0 |
| 11 | 3.0 | 0 | 1.0 |
| 12 | 3.0 | 375 | 0.5 |
| 13 | 4.0 | 375 | 0.5 |
| 14 | 3.5 | 0 | 0.5 |
| 15 | 3.5 | 750 | 0.5 |
| 16 | 3.5 | 375 | 0 |
| 17 | 3.5 | 375 | 1.0 |
| 18 | 3.5 | 375 | 0.5 |
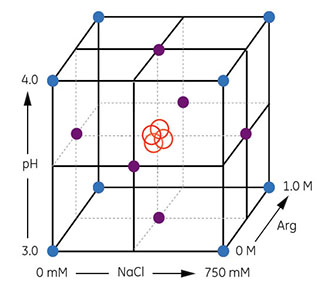
図5.13 上記の実験デザインによる実験条件の三次元的範囲を立方体で表現しています。
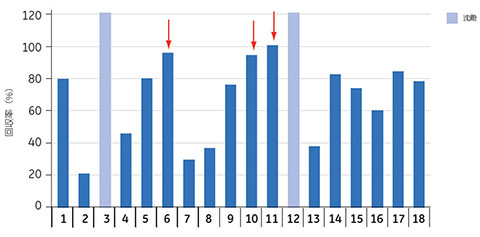
図5.14 280 nmにおける吸収率からモノクローナルヒトIgGの回収率を測定しました。2つのサンプル(薄い青色のバー)でタンパク質の沈殿が生じ、UV吸光度の測定値に乱れが生じました(外れ値)。最大の回収率が得られたのは、矢印で示した実験のサンプルでした。
His Mag Sepharose™ Niと自動化システムを用いたGST-GFP-(His)6の精製条件のスクリーニング
この実験では、GST-GFP-(His)6の最適な精製条件の探索を目的としました。96ウェルプレートの各ウェルに1 μlのHis Mag Sepharose™ Niビーズを入れてTecan™ Freedom EVO™ロボットシステムで処理し、8通りのイミダゾール濃度と4通りのサンプルアプライ量について3回ずつスクリーニングを行いました。サンプルを評価するために、400 nm(この波長ではGFPが強く吸収されます)で吸光度を測定し、さらにDeep Purple Protein Stainで染色したSDS-ポリアクリルアミドゲル(図15.5A)の解析をImageQuant™ TLソフトウェアを用いて行いました。200 mMのイミダゾール濃度ではヒスチジンタグタンパク質は全く結合しなかったことから、ここでは一部のデータ点を省略しています。目的タンパク質の収量と純度との間で最適なバランスが得られたのは、イミダゾール濃度40 mMにおいて総結合能の50~100%に対応するサンプルをアプライしたときでした。
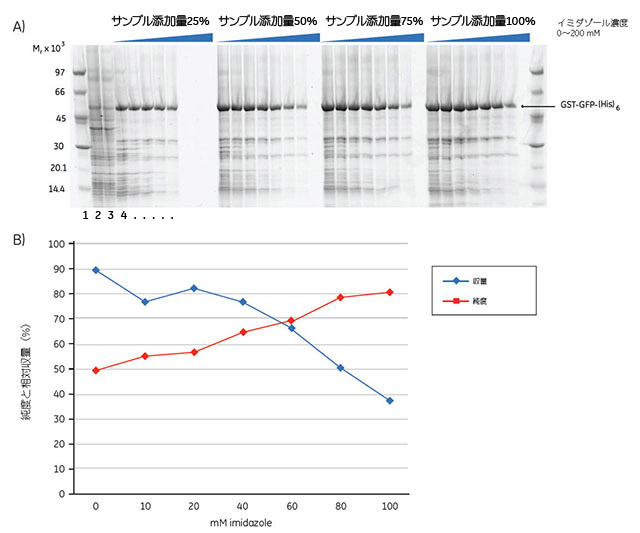
図5.15 (A)E. coli由来タンパク質から濃縮したGST-GFP-(His)6のSDS-ポリアクリルアミドゲル画像。ゲルの両側に低分子量マーカーを示します。レーン2は出発サンプル、レーン3はサンプルアプライ量75%、イミダゾール濃度40 mMのときの素通り画分です。タンパク質はDeep Purple Total Protein Stainと蛍光スキャナを用いて検出しました。GST-GFP-(His)6のゲル上の位置は矢印で示します。ゲル画像はImageQuant™ TLを用いて解析しました。
(B)収量と純度のプロット。イミダゾール濃度200 mMでは結合したタンパク質の量がきわめて少なかったため、この濃度におけるデータ点は省略しました。
His Mag Sepharose™ Niを用いた膜タンパク質可溶化用界面活性剤のスクリーニング
膜タンパク質は、界面活性剤の作用により可溶化します。界面活性剤によって、臨界ミセル濃度は異なります(Critical Micelle Concentrations、表5.6参照)。また、同じ界面活性剤でも温度と塩濃度によってCMC値が急激に変化することがあり、その界面活性剤の可溶化特性に影響します。以下の例(図5.16)には、7通りの界面活性剤を用いた膜可溶化のスクリーニングを示します。His Mag Sepharose™ Niを用いてIMAC(Immobilized metal ion affinity chromatography)精製を行います。Membrane Protein Purification Kitには界面活性剤とビーズが付属します。
表5.6 膜可溶化に対する影響を試験した7通りの界面活性剤
| Detergent | 臨界ミセル濃度(CMC) |
|---|---|
| Lauryldimethylamine-N-oxide (LDAO) | 0.02% |
| Octyl glucoside (OG) | 0.53% |
| Fos-Choline 12 (FOS 12) | 0.05% |
| Decyl Maltoside (DM) | 0.09% |
| Dodecyl Maltoside (DDM) | 0.009% |
| CYMAL™-5 | 0.12% |
| Dodecyl octaethyleneglycol ether (C12E8) | 0.005% |
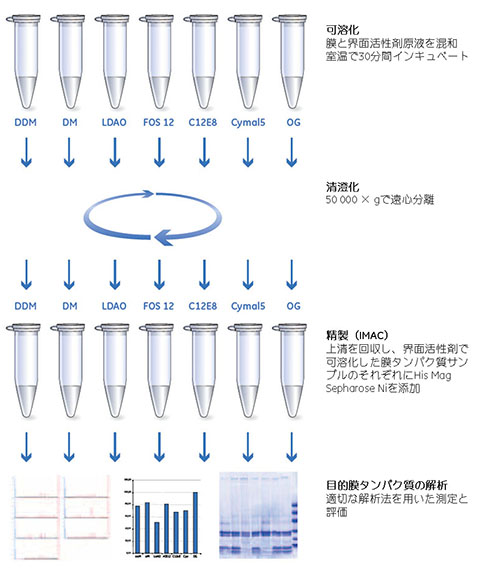
図5.16 Membrane Protein Purification Kitを用いて種々の界面活性剤のスクリーニングを行う手順。このキットに付属のHis Mag Sepharose™ Niビーズを使用すると、きわめて少量のサンプルでスクリーニングが可能です。
References
- Manjasetty, B. A. et al. Automated technologies and novel techniques to accelerate protein crystallography for structural genomics. Proteomics 8, 612-625 (2008).
- Alterovitz, G. et al. Automation, parallelism, and robotics for proteomics, Proteomics 6, 4016–4022 (2006).
- Structural Genomics Consortium et al. Protein production and purifi cation. Nat. Methods 5, 135-147 (2008).
- Joachimiak, A. High-throughput crystallography for structural genomics, Curr. Opin. Struct. Biol. 19, 573-584 (2009).
- Malawski, G. et al., Identifying protein construct variants with increased crystallization propensity – A case study, Protein Science 15, 2718–2728 (2006).
タンパク質サンプル調製ハンドブック目次 |5章 References |略号と用語、記号解説
お問合せフォーム
※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。
お問い合わせありがとうございます。
後ほど担当者よりご連絡させていただきます。
© 2026 Cytiva
