|
|||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
|||||||||||||
|
Location:Home > 実験手法別製品・技術情報 > タンパク質サンプル調製・前処理 |
|||||||||||||
2-D DIGE解析用植物タンパク質抽出バッファーのスクリーニングY. Laurin and P. Oliviusson 二次元電気泳動で明確に分離されたタンパク質スポットを数多く得るには、そのワークフローの中でサンプル調製がきわめて重要なステップとなります。植物組織は、タンパク質抽出、電気泳動を阻害する成分の含量が高く、タンパク質含量が低いことから、扱いが難しい材料です。2-D Protein Extraction Buffer Trial Kitと2-D Clean-Up Kitを組み合わせた新しいワークフローをインゲンマメの葉の分析用に開発しました。精製したタンパク質画分を2-D DIGを用いて分析しました。試験対象としたいずれのバッファーでも、全体として十分な分離能を持ったゲル画像が得られ、スポットの大きさの大半は同等レベルとなりました。ただし、一部のスポットでは使用した抽出バッファーによってスポット大きさが異なりました。 はじめに多くの場合、植物組織はタンパク質抽出の妨げとなる多糖、脂質およびフェノール化合物を多量に含みます。2-D DIGE解析解析用の調製ワークフローには、溶解性をできる限り高め、干渉物質を効率的に除去し、タンパク質分解活性を最小限に抑えられる迅速で効率的な細胞溶解・タンパク質抽出プロトコールが必要です。 2-D Protein Extraction Buffer Trial Kitに含まれているバッファーは、尿素または尿素/チオ尿素をベースとしたもので、バッファーによってCHAPS、SB 3-10、ASB-16などの異なる界面活性剤が添加されていますが、いずれも可溶性を高めることが知られている界面活性剤です。バッファーの調製は、乾燥粉末をキットに含まれている希釈用液と混合することで簡単に行えます。表1に、キットに含まれている6つのバッファーの組成を示します。 表1 2-D Protein Extraction Buffer Trial Kitに含まれている抽出バッファーの組成。青で強調表示したバッファーを、標準2-D溶解バッファー(7 M尿素、2 Mチオ尿素、4% CHAPS)とともに、試験に使用しました。
* Nonylphenyl polyethylene glycol
この試験にはPhaseolus vulgaris(インゲンマメ)の幼苗期の葉を使用しました。2-D Protein Extraction Buffer Trial KitのバッファーIII、IV、V、VIおよび標準2-D溶解バッファー(7 M尿素、2 Mチオ尿素、4% CHAPS)について試験を行いました。抽出後に2-D Clean-Up Kitを使用して夾雑物を除去した後、低蛍光プレキャストDIGEゲルとDIGE Buffer Kitを使用して2-D DIGE解析を行いました。図1にこの試験のワークフロー全体を示します。 タンパク質の抽出抽出バッファーには使用する前に、1% DTT、2% IPG Buffer(pH 3- 10)および10 μl/ml Protease Inhibitor Cocktail VI(P-1545、A. G. Scientific)を添加しました。 各1.1 g前後の葉のサンプル2組を液体窒素中で3分間破砕し、粉状にしました。各サンプルを5つに分け、試験するバッファー1 mlに迅速に混合し、すべてのサンプルの破砕が終了するまで氷上で保存しました。その後、すべてのサンプルを30℃に調整してバッファー成分をすべて完全に溶解させました。サンプルを時々混和しながら30分間インキュベートした後、20℃において16 100 × gで30分間遠心分離しました。上清を回収し、-20℃で保存しました。 タンパク質のクリーンアップ2-D Clean-Up Kitを、100 μg以上のたんぱく質の使用説明書にある処理プロトコールに従って使用しました(1)。最適化した操作は次の通りです。2 mlの丸底マイクロチューブを使用し、その中でタンパク質抽出液150 μlを1液目の沈殿剤(Precipitant)450 μlと混合した後、2液目の共沈剤(Co-precipitant)450 μlと混合しました。沈殿物の洗浄には、ステップ7では100 μlの共沈剤を使用し、ステップ9では100 μlの超純水を使用しました。ステップ9では、まずピペットチップを使用してペレットを拡散させた後にボルテックスしてタンパク質沈殿物を洗浄しました。 次にペレットを洗浄バッファー(wash buffer)1.5 mlで洗浄し、20℃において16 100 × gで遠心分離して沈殿したタンパク質を回収しました。この沈殿物を、30 mMのトリス(pH 8.5)を添加した抽出バッファー50 μlで可溶化しました。可溶化を促進するために、10分間30℃に加温し、数回のピペッティングによりサンプルを混合しました。最後に、可溶化したサンプルを5分間遠心分離し、上清を新しいチューブに移して、不溶性物質をすべて除去しました。タンパク質濃度は、クリーンアップ前は2 ± 0.5 mg/ml、クリーンアップ後は3.9 ± 1.1 mg/mlでした(2-D Quant Kitで測定)。 2-D DIGE標識を行う前に、SDS-PAGEでもサンプルを分析し、完全に溶解、精製されていることを確認しました(図2)。
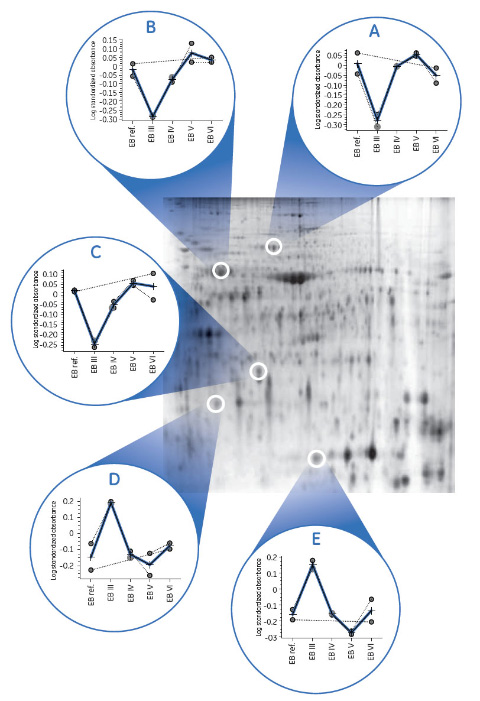
2-D DIGE解析DIGEマニュアル(2)に従ってCyDye™ DIGE Fluor minimal dye標識キットを使用して標識を行いました。各サンプルから得られたタンパク質35 μgをそれぞれCy5とCy3で標識し、プールした内部標準サンプルをCy2で標識しました。各サンプルに計500 pmolの色素を使用し、最終容量を8~14 μlとしました。 Immobiline™ DryStrip gel, pH 3-11 NL (24 cm) を450 μlのDeStreak Rehydration Solutionで再膨潤しました。DTT(最終濃度10 mM)を添加した2-D Protein Extraction Buffer VIをサンプルに加えて最終容量を100 μlに調製し、Ettan™ IPGphor™ 3のCup Loading Manifoldを用い、陽極端からカップローディング法で添加し、電気泳動を行いました。2次元目の泳動にはEttan™ DALTtwelve電気泳動ユニットでプレキャストDIGEゲルとDIGE Buffer Kitを使用して電気泳動を行いました。 ゲルを4℃で一晩保存した後、Typhoon™ FLA 9500でスキャンしました。ゲル画像の解析は、DeCyder™ 2-D Differential Analysis Software v7.0のStudentのt検定に基づくタンパク質統計機能を使用して行いました。 ※DeCyder™ 2-D Differential Analysis Software v7.0は販売終了しましたが、参考情報として掲載しております。 5つのいずれのバッファーでも、十分な分離能を持ったゲル画像が得られ、タンパク質スポットの大きさの大半は同等レベルとなりました。ただし、一部のタンパク質スポットでは使用した抽出バッファーによってスポットの大きさが異なりました。図3には、Extraction Buffer VIで得られたゲルパターンを示すと共に、バッファーによって抽出量が異なるタンパク質の例(A~E)と、特定のゲルスポットにおける各タンパク質の相対存在量の各グラフを示します。最大の差は2-D Extraction Buffer IIIと他のバッファーの間で見られました。 このバッファーは一部のスポット(D、E)には適していましたが、例示した他のスポットでは効率が低くなりました。一方、他のバッファー間では、効率に大きな差は見られませんでした。標準バッファーと2-D Protein Extraction Buffer Vは、両者ともチオ尿素、尿素およびCHAPSをベースとすることから、想定どおり、非常によく似た挙動を示しました。
まとめ2-D Protein Extraction Bufferおよび2-D Clean-Up Kitは、Phaseolus vulgaris由来の植物タンパク質サンプルを2-D DIGE解析する場合に最適な調製ワークフローであり、他の種類の葉からのタンパク質抽出にも有用と考えられます。ここに示した通り、スクリーニング試験で5つの抽出バッファーを比較した結果、タンパク質スポットの一部では、抽出に使用したバッファーによって相対的な存在量が異なることがわかり、この差は特定の目的タンパク質について予備分析を行うときに有用と思われます。 References
お問合せフォーム※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。 お問い合わせありがとうございます。 |
|||||||||||||
© 2026 Cytiva