|
||
|---|---|---|
|
|
||
|
Location:Home > テクニカル情報配信サービス > バイオダイレクトメール > バイオ実験の原理と方法 |
||
抗体精製をマスターしよう (9)モノクローナルIgMの精製
モノクローナルIgMの精製では、他のクローンとのクロスコンタミネーションを防ぐために、クローンごとに専用のカラムを使用してください。
無血清ハイブリドーマ細胞培養液からの精製HiTrap™ IgM Purification カラムによる精製HiTrap™ IgM Purificationカラム(1 ml)のプロトコールです。5 ml 以上にスケールアップをする場合には、HiTrap™ IgY Purificationカラム(5 ml)を使用してください。また、以下のプロトコールの流速およびバッファー使用量を5倍にしてください。 準備するバッファー
サンプルの調製1 ml カラムへの添加培養上清量の計算培養上清中の抗体濃度は 0.01 ~ 0.5 mg/ml 程度です。カラムに添加するサンプル量は、下記方法で求めた最大添加量の1/2 までにします。 サンプル量を増やしたい場合は、HiTrap™カラムを連結してカラム体積を増やすこともできます。
保存中に沈殿が生成することがあるので、使用直前にろ過してください。 HiTrap™ IgM Purification カラムによる精製操作
血清入りハイブリドーマ細胞培養液からの精製血清入りハイブリドーマ細胞培養液から精製する場合、添加した血清由来のウシIgG が精製IgM に混入します。この場合、上述の操作でIgMをアフィニティー精製した後、混入したIgGをHiTrap™ Protein G に吸着させて除去します。 精製IgM中に存在するIgGの除去HiTrap™ Protein G 1 ml カラムの場合のプロトコールです。5 ml カラムを使用する場合は、流速およびバッファー使用量を5倍にしてください。 準備するバッファー
サンプルの調製精製IgM 溶液は HiTrap™ Desaltingカラムで結合バッファーに交換してください。 保存中に沈殿が生成することがあるので、使用直前にろ過してください。 HiTrap™ Protein Gによる精製操作
モノクローナル IgMの精製例HiTrap™ IgM Purificationカラムは、IgMが2-MercaptopyridineにThiophilic interaction(Porath,1985)で結合することを利用した新しいアフィニティー精製カラムです。IgM以外のタンパク質を含まない無血清培養上清を出発材料とした場合には、ワンステップで高純度なIgMを精製することができます。 2-Mercaptopyridineは、血清中のイムノグロブリンやMacroglobulinなどと親和性をもつため、血清成分が多量に含まれるサンプルや血清からIgM を精製する場合は、イオン交換クロマトグラフィーとゲルろ過クロマトグラフィーを組み合わせた精製が必要です。 HiTrap™ IgM Purificationカラムによるアフィニティー精製例5% FCS(ウシ胎児血清)を含むマウスハイブリドーマ細胞培養上清(75 ml)からモノクローナル抗赤痢菌IgMを精製しました。カラムは2-Mercaptopyridineをリガンドに持つHiTrap™ IgMPurificationカラム 1 ml を使用し、「イオン交換クロマトグラフィーを用いたモノクローナルIgG精製プロトコール」にしたがって精製しました。各ステップの回収画分の活性はELISA で、純度はSDS-PAGE とゲルろ過クロマトグラフィーで分析し、純度80 % 以上のIgMが回収されたことを確認しました。 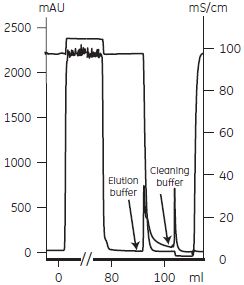 図4-14. マウス モノクローナルIgMの精製 5 ml の結合バッファーでカラムの平衡化を行い、サンプルを添加しました。
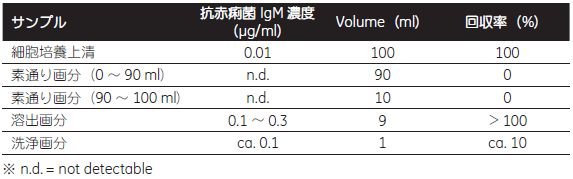 表4-2. 各画分の抗赤痢菌 IgM 活性分析(ELISA) 素通り画分にはIgM 活性はほとんど認められず、回収率はほぼ100 % でした。 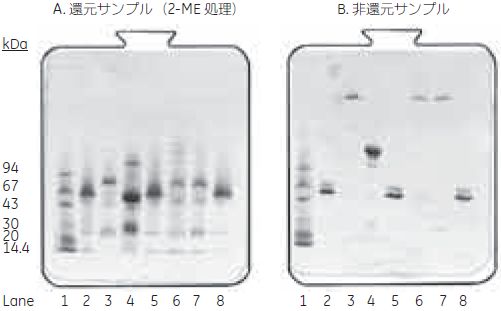 図4-15. 溶出画分のSDS-PAGE 分析
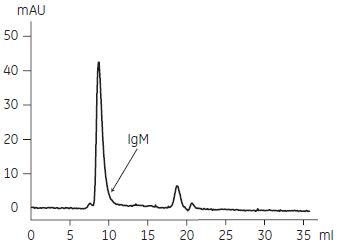 図4-16. ゲルろ過クロマトグラフィーによる溶出画分の分析
ゲルろ過クロマトグラフィーの結果より、純度80 % 以上のIgMがHiTrap™ IgM Purificationカラムによってワンステップで精製されていることが分かりました。 イオン交換クロマトグラフィーとゲルろ過クロマトグラフィーによる精製例イオン交換クロマトグラフィーは、高い分離能を示すため複雑な成分の分離に非常に有効な精製方法です。ここではFCSを含むハイブリドーマ細胞培養上清からIgM を精製した例を紹介します。pH 5.0 以上でAlbuminは陽イオン交換カラムを素通りしますが、モノクローナルIgMは種類によってカラムに吸着する場合があります。非吸着成分を洗浄した後、塩濃度のリニアグラジエントでIgMを溶出しました。さらにIgMの分子量(900 kDa)が夾雑タンパク質に比べて大きいことを利用して、ゲルろ過クロマトグラフィーにより最終精製を行いました。 精製操作
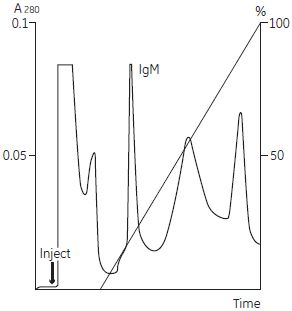 図4-17. 陽イオン交換クロマトグラフィーによる1段階目の精製
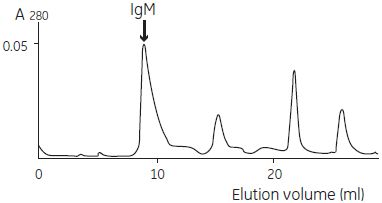 図4-18. ゲルろ過クロマトグラフィーによる2段階目の精製
※ モノクローナルIgM を高濃度のウシ胎児血清(FCS)を含むハイブリドーマ細胞培養上清から精製する場合には、電気泳動によりIgM の溶出位置を確認してください。 ※ モノクローナルIgM の等電点は個々のIgM によって大きく異なるため、この条件で精製できるとは限りません。最適な純度と回収率を得るためには、ここに示された条件を目安にして結合条件の至適化を行ってください。 血清を添加した細胞培養液からの精製では、IgGが混入することに注意しましょう。精製純度をあげたい場合には、IgMの分子量が大きいことを利用し、ゲルろ過クロマトグラフィーを試してみるのが良いでしょう。 次回は、Yolk sac抗体IgYの精製プロトコールをご紹介します。 お問合せフォーム※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。 お問い合わせありがとうございます。 |
||
© 2026 Cytiva