DIGE定期便 第3号
~二種類の蛍光標識法を極める(後編:タンパク質同定までの流れ)~

この「DIGE定期便」では、毎回Ettan™ DIGEに関するアプリケーションやちょっとしたテクニックなどをご紹介します。DIGEで用いる蛍光標識法には、Minimal Labelling(ミニマルラベリング)法とSaturation Labelling(サチュレーションラベリング)法の2つがあります。前編では基本的な特徴についてご紹介しましたが、後編ではタンパク質同定までの流れをご紹介いたします。
● 二種類の蛍光標識法を極める (前編:それぞれの特徴)
● まずEttan™ DIGEについて詳しく知りたい方のために
 Ettan™ DIGEの技術概要についてはコチラ
Ettan™ DIGEの技術概要についてはコチラ
コンテンツ内容
- はじめに
- Minimal Labelling法 (ミニマルラベリング法) からのタンパク質同定
- Saturation Labelling法(サチュレーションラベリング法)からのタンパク質同定
- 蛍光検出ゲルスポットの切り出し方法
- まとめ
1. はじめに
DIGE解析を検討している方の多くが口にする質問の一つが、「DIGE解析で発見した興味深いタンパク質スポットを、どのようにタンパク質同定するか」という点です。ある程度そのタンパク質スポットが予測できる場合などでは、ウェスタンブロッティングで確認することもできます。しかし、未知のタンパク質スポットである場合にはアミノ酸シークエンシングまたは質量分析計(MS)を用いた同定が必要です。ここではDIGE解析~MSによる同定操作直前までの流れ、すなわち「DIGE解析で興味の湧いたスポットをどのように切り出すか」までを中心にご紹介いたします。
ミニマルラベリング法とサチュレーションラベリング法では注意しなければならない点が若干異なりますので、標識法ごとにその方法を確認していきましょう。
※DeepPurple、DeCyder™ 2D Softwareは販売終了しておりますが、参考情報として掲載しております。
2. Minimal Labelling法 (ミニマルラベリング法) からのタンパク質同定
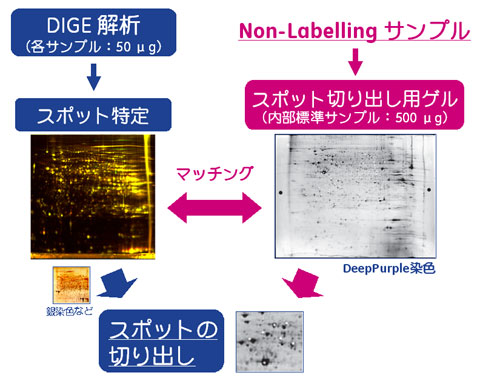
図1 タンパク質スポット切り出しの流れ(ミニマルラベリング法)
図1にミニマルラベリング法からのタンパク質切り出しまでのフローを示しました。解析ゲルでは十分なタンパク質量が得られないなどの理由から、別途にタンパク質量を多く泳動した切り出し用ゲルを準備する手法を推奨しています。
解析ゲルとは別に切り出し用ゲルを準備する場合(ミニマルラベリング法)
ミニマルラベリング法によるDIGE 解析において泳動しているタンパク質量は、3色分(Cy2/Cy3/Cy5)をあわせても150 μgです。仮にサンプルから3,000 スポットが検出されたとすると、1タンパク質スポットあたりのタンパク質量は150/3000 = 50 ngになります。一般的なMSの検出感度を考えると十分な量ですが、ゲルからの抽出効率やタンパク質ごとの発現量差を考慮に入れると、同定が難しいタンパク質スポットも多く存在するとが考えられます。
そこで、泳動するタンパク質量500 μgに増やした“スポット切り出し用ゲル”を用意する手法を推奨しています。また、解析ゲル用のサンプルは標識せずに泳動します。解析ゲルとのスポット対応付け(マッチング)は同じサンプル同士の比較であるため、容易にスポットを特定することができます。検出はDeepPurpleやSYPRO™ Rubyなどの蛍光試薬による検出、銀染色、またはCBB染色などで行います。
また、標識の有無によるタンパク質分子量の差はCyDye™1個分(500 Da程度)です。標識の有無で電気泳動の移動度が分子量方向に多少ずれますが、無理なくマッチングできる程度のものであり、スポットの対応付けができないということはほとんどありません。図2にCy標識のあり/なしのサンプルを同一ゲルに泳動したパターンを示しますので、ご参照ください。
※18 cmや24 cmのImmobiline™ DryStripゲルでは500 μgよりも多いタンパク質量を泳動することもできますが、安定した泳動パターンを得ることを考慮した結果「500 μg」を推奨量としています。

図2 Cy5標識の有無によるスポットパターンの比較
図2 Cy5標識の有無によるスポットパターンの比較
緑:Cy5 ミニマルラベリング(標識されているタンパク質スポット)
赤:DeepPurple染色(標識されていないタンパク質スポット)
アクリルアミド濃度:12%
【図2の解説】
Cy5標識したタンパク質を泳動したゲルをDeepPurpleにより染色し、Cy5、ならびにDeepPurple検出条件で蛍光検出したゲルイメージ
この泳動例では標識の有無によってタンパク質スポットの位置がどの程度ずれるかを示しています。高分子量エリアでは目立ちませんが、低分子量エリアでは標識の有無によって縦方向(分子量)にスポット位置がずれていることがわかります。しかし、横方向(等電点)のズレは見られないため、スポットのマッチングにはほとんど影響がありません。
ミニマルラベリング法で解析したゲルからの切り出し
ここでは、以下の2点に注意する必要があります。
- ミニマルラベリングによって標識されるタンパク質の割合は全体に対して1~2%程度であり大部分が標識されていないこと
- 標識の有無によって分子量がずれるため、スポットの位置がずれること(上記の図2参照)
以上の理由から、蛍光検出イメージから得られるスポットの位置を正しく切り出しても、目的タンパク質スポットを単離することはできません。別の方法(CBB染色や銀染色など)でタンパク質を染色して大部分の標識されていないタンパク質の位置を確認し、タンパク質スポットを切り出しましょう。
この方法では、解析ゲルからの切り出しスポット特定が容易であることや、無駄なくサンプルを利用できるなどのメリットがあります。しかし実際には、スポットあたりのタンパク質量が不十分であることが多く、信頼性の高いMS同定結果を得るには及びません。フラクショネーションしたサンプルなどある程度タンパク質スポット数が少ない場合においては、この手法を試してもよいかもしれません。
3. Saturation Labelling法(サチュレーションラベリング法)からのタンパク質同定
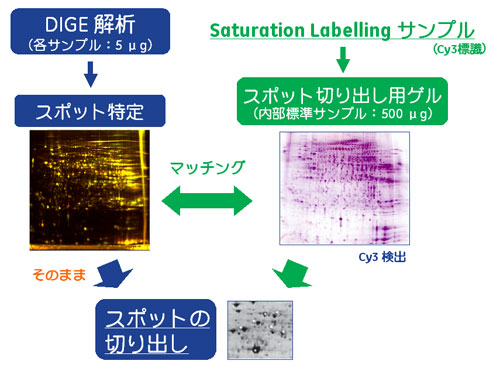
図3 タンパク質スポット切り出しの流れ(サチュレーションラベリング法)
図3にサチュレーションラベリング法からのタンパク質切り出しまでのフローを示しました。ミニマルラベリング法よりもさらに解析に使用するタンパク質量が少ないため、切り出し用ゲルの有用性がより高まります。
解析ゲルとは別に切り出し用ゲルを準備する場合(サチュレーションラベリング法)
サチュレーションラベリング法では解析に用いるタンパク質が1/10(5 μg/サンプル)であるため、ミニマルラベリングに比べて、よりタンパク質同定の難易度が上がります。
したがって、
タンパク質量を増やして(500 μg)泳動する切り出し用ゲルを準備する方法がより有効です。この場合は、
サンプルをSaturation Dyeで標識する必要があります。それぞれのタンパク質に含まれるシステインの数によって、スポット位置が分子量方向に大きくずれる可能性があるためです。その代わり、解析ゲルと切り出し用ゲル間でのスポットマッチングはより簡単です。
サチュレーションラベリングを必要とするようなサンプルでは、なかなか500 μgものタンパク質を得ることが難しい場合も多いと思います。できるだけ多くのタンパク質量を得られるよう工夫をして、スポット切り出し用ゲルを調製してみてください。
サチュレーションラベリング法で解析したゲルからの切り出し
サチュレーションラベリング法ではサンプル中のタンパク質に含まれる全てのシステインを標識します。よって、ミニマルラベリング法と違い、解析時に検出したスポット位置を切り出せばOKです。何らかの要因でサンプルの取得に限りがある場合は、直接切り出してMS解析を行うしかありませんが、ミニマルラベリング時よりも解析タンパク質量が少ないため、同定はさらに困難です。
Saturation Dye標識タンパク質同定における注意点
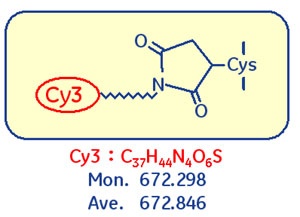
図4 Saturation Dyeのシステインへの付加
サチュレーションラベリング法におけるMS解析では、いくつか注意しなければならない点があります。
タンパク質の検出強度とタンパク質量の関係
サチュレーションラベリング法の場合、スポットの検出感度はタンパク質に含まれるシステイン残基に依存します。システイン残基を多く含むタンパク質は強く検出される傾向がありますので、注意が必要です。しっかり検出できている場合でも、タンパク質量が少ない場合が考えられます。(反対に検出強度が弱くても意外に十分なタンパク質量がある場合もあります)
蛍光標識による分子量のずれ
MSやアミノ酸シークエンシングによりタンパク質を同定する際には、システインに付加するCyDye™の分子量を考慮する必要があります。Cy3標識の場合、システインを含むペプチド断片は分子量が「672.298(モノアイソトピック)」だけ付加します。同定の際のデータベース検索時には、システイン残基を含むペプチドの分子量に「672.298」が足されるよう設定してください。
(補足)
システイン + Saturation Dye Cy3標識ペプチドのMS検出において、蛍光色素の付加から予測されるペプチド分子量の増加(上記参照)に加えて、さらに分子量が「18」付加された状態でペプチドが検出される現象が確認されています。これは、Saturation Dyeがもつマレイミド構造に水分子が付加されるためと考えています。ピークが強い強度で検出されているにも関わらずデータベース検索で同定タンパク質が見つからない場合には、この現象を考慮した条件での検索をお試しください。
4. 蛍光検出ゲルスポットの切り出し方法
目に見えない蛍光検出ゲルスポットの切り出し方法としては、
- スポット位置を読み込ませたシステムによってゲルスポットを切り出す
- 等倍打ち出ししたゲルイメージをもとにマニュアル操作でゲルスポットを切り出す
の2手法があります。
弊社ではDeCyder™ 2D Software、あるいはImageMaster DIGEといったEttan™ DIGE解析ソフトウェアに対応したピッキングシステムEttan™ Spot Pickerをご用意しています。Ettan™ Spot Pickerは解析ソフトウェアからエクスポートされるピックリストの座標情報をもとに、正確にゲルの切り出しを行う機械です。
等倍打ち出しイメージをもとにしたゲルスポットの切り出しは、ゲルイメージが印刷されている紙をゲルの下にピッタリと重ね合わせ、印刷イメージをもとにスポットの位置を確認しながらゲルの切り出しを行う方法です。プリンターの印刷精度、ゲルと等倍打ち出しイメージ間のずれをいかに抑えるかなどを考慮する必要があります。CBB染色ゲルや銀染色ゲルなど可視で確認できるサンプルで十分な検討を行ってから、蛍光検出ゲルの切り出しにチャレンジしてみてください。
5. まとめ
ミニマルラベリング法・サチュレーションラベリング法のどちらも解析時に泳動するタンパク質量は少ないため、500 μgのタンパク質を泳動したタンパク質切り出し(同定)用のゲルを別途に用意することをおすすめします。解析ゲルと切り出し用ゲルのスポットマッチングに不安を感じる方もいらっしゃるかもしれませんが、一般的なサンプルであれば苦労を伴わず実験を進められます。このことは、Ettan™ DIGEに関連する300以上の論文が報告されていることからもその事実が裏付けられています。
もし、タンパク質同定までの過程でわからない点などございましたら、お気軽に弊社バイオダイレクトラインまでお問合せください。
※次回の「DIGE定期便」の内容は未定ですが、次回もご期待ください。Ettan™ DIGEがもっともっと一般的な技術になるよう、魅力をお伝えできればと思っています。
○ Ettan™ DIGE文献リスト
● 二種類の蛍光色素を極める 前編

