|
||
|---|---|---|
|
|
||
|
Location:Home > テクニカル情報配信サービス > ProteinSciences Club > ウェスタンブロッティング |
||
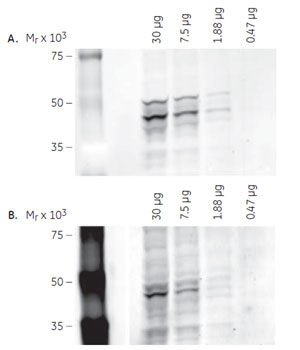
ECL Plex™と二次元ウェスタンブロッティングの組合せアプリケーション蛍光ウェスタンブロッティング試薬ECL Plex™を用いたGSK3βの検出例をご紹介します。ここでは、1-Dウェスタンブロッティング(SDS-PAGE)と2-Dウェスタンブロッティングの双方で検出を行いました。二次元電気泳動の分離能と蛍光ウェスタンブロッティングの多重検出を組み合せることで、1-Dウェスタンブロッティングでは得られない情報を得ることができました。 参考:蛍光ウェスタンブロッティングを使った多重検出アプリケーション 1-D ウェスタンブロッティングによるGSK3βの検出実験の流れPC-3U細胞をRIPAバッファー(50mM Tris-HCl, pH8.0, 150mM NaCl, 10% glycerol, 1% NP40, 0.5% Deoxycholate)に溶解し、miniVEによりSDS-PAGEを行いました。次に、TE 22 Mini Tank Transfer Unitにより低蛍光PVDFメンブレンHybond™-LFPに転写した後、ECL Plex™により検出反応を行いました。一次抗体として、マウス由来の抗GSK3βモノクローナル抗体(TBST, 1,000倍希釈、以下、抗GSK3β抗体)と、GSK3βのSer 9のリン酸化を認識するウサギ由来の抗リン酸化GSK3βポリクローナル抗体(以下、抗pGSK3β抗体)を用いました。二次抗体にはECL Plex™のgoat-α-mouse IgG-Cy3, goat-α-rabbit IgG-Cy5(TBST, 2,500倍希釈)を用い、Typhoon™ 9400により蛍光検出を行いました。 ※使用した抗体などの試薬、プロトコールの詳細は英文アプリケーションノートをご参照ください。 1-D ウェスタンブロッティングの結果検出結果を図1に示します。抗GSK3β抗体では、48 kDaと51 kDa付近にバンドが検出されました(A)。その内、51 kDaに見られるバンドはGSK3αによるクロスリアクションによるものと予測されました(抗体製造元の情報より)。 また、抗pGSK3β抗体では、48 kDaと49~50 kDa付近にバンドが検出されました(B)。 48 kDa付近のバンドはSer 9がリン酸化されたpGSK3β由来と考えられます。49~50 kDa付近に検出されたバンドについては、非特異的検出であるのか、アイソフォームなどに起因して移動度が変わったpGSK3β由来であるのかは、1-Dウェスタンブロッティングの結果からは確証できませんでした。 ※この実験では、TGF-βなどを用いたGSK3βの活性化処理(リン酸化亢進)は行っていません。細胞内では、GSK3βのリン酸化/脱リン酸化のプロセスが常に起こっていることがわかります。
1-Dウェスタンブロッティングの結果図1(左):非リン酸化/リン酸化GSK3βの検出 A. 抗GSK3β抗体による検出
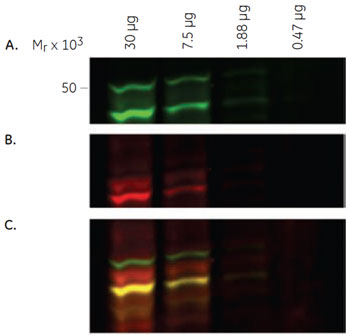
図2(右):検出結果の多重蛍光カラー表示 A. 抗GSK3β抗体による検出(緑)
両抗体による検出の重ね合わせイメージ(C)から、A.で検出された48 kDa付近のバンドにはリン酸化されたGSK3βが含まれていることが推測されます(赤と緑が重なって黄色に見えています)。 2-D ウェスタンブロッティングによるGSK3βの検出実験の流れ二次元電気泳動1-Dウェスタンブロッティングと同様にPC-3U細胞ライセートを調製後、2-D Clean-Up Kitでサンプルの脱塩・清澄化を行いました。泳動には、25 µg のライセートと、CyDye™ DIGE Fluor, Cy2 minimal dye で標識したライセート5 µgを混合したサンプルを使用しました。 GSK3βの等電点が8.95であることから、等電点電気泳動には7 cmのImmobiline™ DryStrip pH7-11を用いました。Ettan™ IPGphor™で等電点泳動後、miniVE によるSDS-PAGEで二次元展開しました。 2-Dウェスタンブロッティング上記の1-Dウェスタンブロッティングと同様の方法で検出を行いました。 2-Dウェスタンブロッティングの結果泳動前にCy2で標識したライセートを用意し、未標識サンプルと混合して泳動しました。これにより、ECL Plex™による抗体反応の検出と同時に(Cy3, Cy5)、泳動された全タンパク質をCy2で検出することができます。 図3が、2-Dウェスタンブロッティングの蛍光検出イメージです。イメージを見ると、GSK3βが連なるスポット群として検出されていることがわかります。これらスポット群の等電点変化は、リン酸基が付加された場合とほぼ一致していたことから、GSK3βがもつ6つのリン酸化部位(Ser9, Ser21, Thr43, Tyr216, Ser389, Thr390)によって分離されていると推測されました。また、酸性側に検出されている2つのスポットのみが、今回用いた抗pGSK3β抗体で検出されていることから、Ser9がリン酸化されたアイソフォームが2種類あることが示されました。 さらに、2-Dウェスタンブロッティングで検出された2つのスポットは、1-Dウェスタンブロッティングで抗pGSK3β抗体により検出された49-50 kDa付近のバンドと分子量が異なっていました。このことより、49-50 kDa付近に検出されたバンドがGSK3βとは無関係の非特異的検出であることが示唆されました。 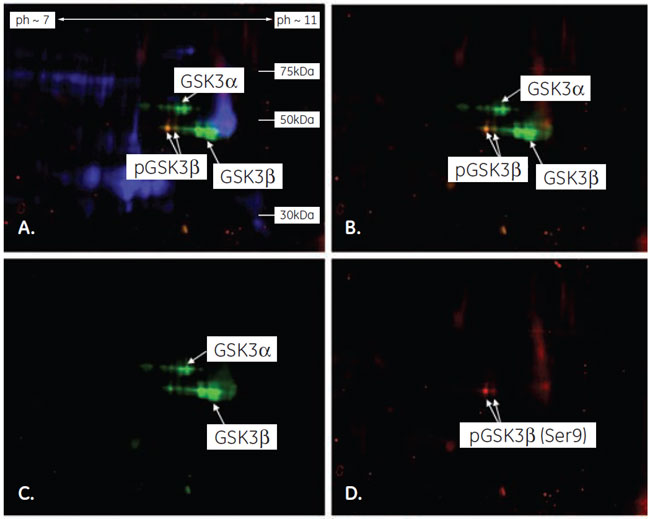
図3 2-Dウェスタンブロッティングの結果A. 抗GSK3β抗体(Cy3, 緑)+抗pGSK3β抗体(Cy5, 赤)+全タンパク質(Cy2, 青)
まとめ蛍光多重検出と二次元電気泳動を組み合せた2-Dウェスタンブロッティングでは、1-Dウェスタンブロッティングよりも多くの情報が得られます。本報告では、1-Dウェスタンブロッティングではひとつのバンドで検出されていたシグナルが、2-Dウェスタンブロッティングによって5つのスポットに分離され、その内の2つのアイソフォームでは、Ser9がリン酸化されていることが明らかになりました。 さらに、泳動前のタンパク質をCy2標識することで、容易に全タンパク質の検出が可能です。蛍光ウェスタンブロッティングにおいて異なるゲル間で抗体検出シグナルを比較する際には、非常に有用な手法です。
お問合せフォーム※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。 お問い合わせありがとうございます。 |
||
© 2026 Cytiva