|
|||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
|||||||||||||
|
Location:Home > テクニカル情報配信サービス > Pure Protein Club |
|||||||||||||
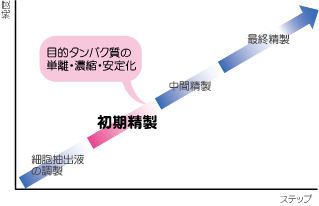
3段階精製ストラテジー【2】 初期精製(Capture)ステップ
|
|||||||||||||
| 精製ステップ | 目的 | 精製方法の選択に重要なファクター |
|---|---|---|
| 初期精製 | 目的タンパク質の単離、濃縮、安定化 | 処理容量、処理速度 |
| 中間精製 | 大量に含まれる不純物の除去 | 処理容量、分離能 |
| 最終精製 | 微量の不純物、目的タンパク質に特性がよく似た物質の除去 | 分離能、回収率 |
初期精製(Capture)ステップ
さて、いよいよ最初の精製ステップをはじめるわけですが、初期サンプル溶液中には上述のように非常に多くの夾雑タンパク質が含まれます。これら夾雑物の中にはプロテアーゼやグリコシダーゼのように目的タンパク質を分解してしまったり、機能を奪ってしまうような働きをするタンパク質も多数存在しており、目的タンパク質にとって実に危険きわまりない環境であると言えます。また一般にこの時点ではサンプルの液量も多いため、初期精製ステップでは“目的タンパク質をより安定な環境に移すこと”+“濃縮して液量を減らす事”が必要になります。
実際に用いる手法は、ケースによって様々です。
たとえば組換えタンパク質や抗体の場合は、アフィニティークロマトグラフィーをCaptureステップで行うことが多いですし、またサンプルの前処理で硫安沈殿による清澄化を行った場合には塩強度の高い状態を利用してそのまま疎水性相互作用クロマトグラフィーを行うケースもあります。このように選択肢はいくつかありますが、総合するとCaptureステップではイオン交換クロマトグラフィーが採用されるケースが多いといえます。
その理由としては、次の点が挙げられます。
- どんなタンパク質にも共通して使用できる方法である:特定の条件がそろわないと使用できないアフィニティークロマトグラフィーと違い汎用性が高い
- 速い流速で精製・濃縮できる:目的物を含むタンパク質群を素早く吸・脱着させることで、大雑把な精製に加え濃縮をかけられる
以上のことから、Captureステップで重要とされる要素を満たしていることがおわかりいただけると思います。
イオン交換クロマトグラフィーでは、バッファーpHや洗浄ステップの塩濃度を変えることにより吸着されるタンパク質をある程度コントロールすることが可能です。pHおよび洗浄ステップでの塩濃度を慎重に至適化して夾雑物の吸着をできるだけ減らし、目的タンパク質の結合量が最大になるような開始条件を選ぶことに注力しましょう。
また、初期精製の段階では分離能よりも処理容量や処理速度を高くすることが求められますので、比較的大きな粒子径(>90 μm)の担体が多く用いられます。弊社の担体では、 Sepharose™ Fast Flow (粒子径90 μm)などがこれにあたり、実際の製品ではHiTrap™ Q FF、HiTrap™ SP FFなどがあります。
イオン交換クロマトグラフィーについてもっと知りたい方は↓↓をクリック!
このように、Captureステップの合い言葉は、“質より量とスピード!”です。本ステップで得られた目的タンパク質を含むフラクションは、初期サンプルとくらべておよそ半数見当の夾雑物が取り除かれ、比較的安定に濃縮された状態となります。
しかしまだまだ安心できません。プロテアーゼやグリコシダーゼが一緒に回収されていることは十分考えられます。この後も気を抜かず、次のステップへ間をおかずに進みましょう。
次回は中間精製での留意ポイントをご紹介します。
三段階精製ストラテジー 全4回
- 三段階精製ストラテジー【1】 序章 ~精製の基本戦略と煮物作りの意外な関係~
- 三段階精製ストラテジー【2】 初期精製(Capture)ステップ ~合い言葉は“質より量とスピード!~(本ページ)
- 三段階精製ストラテジー【3】 中間精製(Intermediate Purification)ステップ ~目的分子を追い詰めろ!~
- 三段階精製ストラテジー【4】 最終精製(Polishing)ステップ ~いよいよ千秋楽!~
お問合せフォーム
※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。
お問い合わせありがとうございます。
後ほど担当者よりご連絡させていただきます。
© 2026 Cytiva