笠井献一先生
探日録 第2回:「出来損ないさん」のおかげです 《後編》
ユニークな相互作用研究法「フロンタル・アフィニティークロマトグラフィー」の誕生と成長
第2回 アフィニティークロマトグラフィーと酵素反応速度論は兄弟?
初めて作った親和性吸着体は出来損ないでした。目的物がしっかり吸着されずに漏れてしまう代物でした。でもよく見ると、吸着力が弱ければ早く漏れ始め、強ければ遅く漏れ始めていました。それなら、これを定量的に取り扱えば結合力の測定手段になりうる。でもどうすれば数式化できるかお手上げでした。
その時にまた石井先生が、前端分析(フロンタル・アナリシス)が良いのではとヒントをくれました。ふつうのクロマトグラフィーとは違って、低濃度の分析対象分子(以後アナライトと呼びます)の溶液を流し続け、いつ漏れ出すか(溶出容積)を観察します。
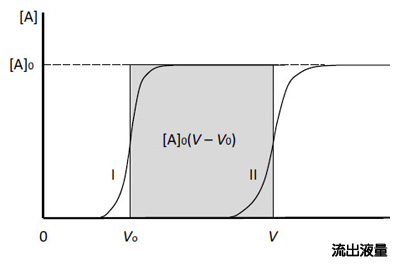
縦軸はアナライトの濃度。横軸がカラムからの流出液の液量。曲線IIがアナライトの溶出パターンで(溶出容積:V)、曲線 Iが素通りする物質(コントロール)の溶出パターン(溶出容積:V0)。これら2つの曲線で囲まれた部分の面積が、固定化リガンドに結合しているアナライト量に等しい。
目的物を分離しようとするのではなく、解析目的に特化したやり方です。出来損ない吸着体だからこそ適用できるのであって、出来の良い強い吸着体には適用できません。いくら待っても目的物は漏れてこないのですから。さて、このやり方だと系がびっくりするほど単純化されました。クロマトグラフィーで得られるデータと、相互作用を規定するパラメーターとの関係を、数学に弱い私でも数式化できました。それが1式です。誘導の仕方などは文献(5, 6)をご覧ください。
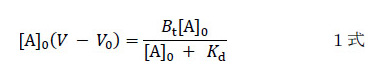
[A]0はカラムに添加したアナライト溶液の濃度、V0は素通りする物質の溶出容積(コントロール)、Vはアナライトの溶出容積(漏れ始め)、Btは固定化リガンドの総量、Kdはアナライトと固定化リガンドの複合体の解離定数です。左辺はカラム内の固定化リガンドに結合しているアナライトの量(注2)を示し、[A]0を変数とする分数関数(直角双曲線)になっています。
この式を眺めていたとき、どこかで見たような気がしました。そして、はたと気づきました。酵素反応速度論の基本、ミカエリス・メンテン式です。[A]0(V – V0)を反応速度、Btを最大速度、Kdをミカエリス定数に置き換えれば同じ式だとわかります。
つまりフロンタル方式でクロマトグラフィーをやれば、ラングミュアーの吸着平衡式に従う飽和現象になるのです。後から考えればいたってあたりまえのことですが、式の誘導に成功するまで気がつきませんでした。目から鱗が落ちました。
この式からさらに素晴らしい式が導かれます。できるだけ薄いアナライト溶液を使うと(Kdに対して無視してよいほど。たとえばKdの100分の1以下)、1式の右辺の分母にある[A]0を無視できるので、2式のような簡単な式になります。つまり飽和度がほぼゼロのときには、こんな簡単な関係が成り立つのです。
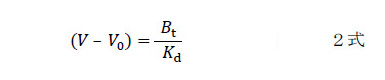
これはアナライトの遅れ方がKdに反比例する、言い換えればKa(結合定数)に比例するということです。固定化リガンドの総量Btがわかっていれば、アナライトの漏れ始めを測定するだけで結合力を決められる。これぞFACの真骨頂。これほど原理も操作も簡単な相互作用研究法は他にはありません。この強みを生かしてトリプシンの認識能力についてじつに多くのことを知ることができました。
レクチンと糖の相互作用もFACで解明できる
こうしてできたフロンタル・アフィニティークロマトグラフィー(以後FACと省略)にはじつに多くの利点がありました。たとえば、酵素に限らず、相互作用する系全般に使えます。平衡状態を壊さずに測定でき、弱い相互作用を解析するのにうってつけです。強い相互作用ならいくらでも手段がありますが、弱い相互作用が得意な研究法はおそらくFAC以外にはありません。弱い相互作用であっても極低濃度のアナライトで測定でき、しかもアナライトの正確な濃度がわからなくてかまわない。必要な装置はフラクションコレクターが一台だけ。
そこでこの方法の応用範囲をもっと広げたいと思い、当時(1970年代)いちばん手段が欠けていたレクチンを取り上げました。レクチンと糖の相互作用は一般に弱い。生体内に存在する糖鎖は多様すぎ、しかも微量。有機合成は困難をきわめる。平衡透析、差スペクトル法などを実施できるほどの糖試料を用意するのは不可能でした。レクチンと生体内の複雑な糖鎖との結合定数を求めるなど夢物語でした。でもFACはアナライト濃度がいかに低かろうと、漏れ始めさえ測定できればよい。そこでコンカナバリンA(ConA)をセファロースに固定化してカラムにつめました。卵白アルブミンに結合している複雑な構造のN-結合型糖鎖を10種類以上切り出してトリチウム標識しました。これをアナライトとして流し、解離定数を次々と決定しました。その結果、ConAの糖鎖認識の基本原理を初めて明らかにすることができました(6)。
レクチンを糖結合特性にもとづいてプロファイリング
FACが糖鎖生物学の分野にも役立つことが分かりましたが、もっと発展させるにはどうしたらよいか、しばらくヒントがつかめませんでした。ところが1990年代に新展開が訪れました。アメリカの糖質関係の学会に参加していた平林淳さん(当時の研究室スタッフ)の土産話から始まります。とある発表で私の名前がだしぬけにスライドに映し出され、「えっ?なに?」と思ったら、FACを高性能化したという発表でした。ヒンズガウルのグループが、HPLCを使ってFACを行い、有機合成した糖関連物質を、レクチンに対する親和力でスクリーニングしたというのです。しかもレクチンカラムに同時に複数のアナライト分子を添加し、LCMSを検出器に使って、一挙に溶出容積を測定してしまうことまでやっていました。
これには大いに刺激を受けました。研究室ではガレクチンの研究に力を入れていましたが、糖鎖認識特性の詳細を解明できず、切歯扼腕していました。FACの高性能化で突破口を開けるのではないかと、スタッフ、院生達が情熱的に取り組んでくれて、私たちの研究室独自の素晴らしいシステムができました(7)。いろいろな点で機が熟していました。特筆すべき一つは、蛍光標識オリゴ糖鎖をアナライトとして使える状況になっていたことです。大阪大学の長谷純宏さんのグループがピリジルアミノ化(PA化)法を開発し、100種類くらいの複雑な構造の糖鎖がPA化されていて、試薬として入手できる状況になっていたおかげで、FACの超微量化・高速化が実現しました。
使うのはごく普通のHPLC装置です。例えば内容積が0.1 mL程度のカラムに固定化レクチン吸着体をつめ、10 nM程度のPA糖鎖溶液を流します(流速0.25 mL/min、全部で2 mL)。流出液を蛍光検出器に導いて溶出状況を測定。表計算ソフトを利用して作ったプログラムでデータからただちに解離定数を算出。PA糖鎖1種類あたり10分程度というペースで結合力が決まります。操作はごく簡単で、卒業研究の学生でもすぐに出来るようになり、1日で20種類以上のPA糖鎖を調べられるようになりました。
高性能FACシステムはレクチン研究を様変わりさせました。個々のレクチンについて100種類もの糖鎖に対する正確な結合力が簡単に決められ、糖認識能力プロファイルが得られます。これで私たちのガレクチン研究は大躍進しましたが、そればかりでなく、レクチン全般について、結合特性をこれまでにないほど詳しく解明できるようになりました。平林さんは産総研に移ってから、全自動FAC装置を作り、すでに100種類以上のレクチンの糖結合特性プロファイルを集め、レクチンデータベースとして公開しています。
弱い相互作用が生命を支える もっと研究しなければ
糖鎖が情報分子として関わる現象は、弱く、ファジーで、関わる糖鎖が多様かつ複雑すぎ、ごく一部しか解明が進んでいません。それだけにこの分野にはいくつもの未知の生命原理発見のチャンスが潜んでいるはずで、チャレンジする価値が大きいです。生体内で休み無く行われている調節現象(ひんぱんなスイッチのオン・オフ)のほとんどは、実は弱い相互作用が取り仕切っています。強い相互作用系は迅速にオフできないからです。生命現象を究めるには、弱い相互作用の深い理解が必須です。
相互作用研究手段は、近年、新しい原理(表面プラズモン共鳴、水晶発振子など)を土台にいくつも開発されていて、平衡定数に加えて速度定数(結合速度、解離速度)まで測定できるものも多いです。それらに比べると、FACは平衡定数しか求められません。しかし、弱い相互作用を極微量の糖鎖で解析できるという点で、現在の状況でFACに勝るものはまだ出ていません。
その理由はこうです。ほとんどの相互作用研究手段は、相互作用で形成された複合体のシグナルの強度に頼っています。だから複合体が少ししか形成されず、かつすぐに壊れてしまう弱い相互作用系は苦手です。ところがFACはアナライトが固定化リガンドと接触した頻度を移動の遅れとして測定するので、シグナル強度に頼る必要がないのです。ここから弱い相互作用を得意とすることや、いくら低濃度でもよいこと(原理的には1分子でも可)、その他のさまざまな利点がでてきます。テクノロジーの進歩が手伝えば、さらなる微量化、ハイスループット化の可能性が大いにあるでしょう。FACの原理が、クロマトグラフィーの枠を超えて、リターデイション・アナリシスとして大発展することも夢ではないなとひそかに期待しています。
私は研究の第一線からは退きましたが、自分で始めたFACが、巡り巡ってメインテーマのひとつだったレクチン研究に大貢献することになったことは幸せの限りでした。出来損ないの親和性吸着体が、そしていくつもの予期せぬ偶然の出会いが、私を導いてくれました。
「実験が失敗したら大喜びしなさい」
江上不二夫先生から何百回も聞かされた座右の銘です。
(注2)カラム内は動的平衡状態になっていて、結合状態にあるアナライトは次々と入れ替わっている。
参考文献
- Kasai, K. and Ishii, S. (1975) Quantitative analysis of affinity chromatography of trypsin. A new technique for investigation of protein-ligand interaction. J. Biochem. 77, 261-264
- Ohyama, Y., Kasai, K., Nomoto, H. and Inoue, Y. (1985) Frontal affinity chromatography of ovalbumin glycoasparagines on a concanvalin A-Sepharose™ column. A quantitative study of the binding specificity of the lectin. J. Biol. Chem. 260, 6882-6887
- Hirabayashi, J., Hashidate, T, Arata, Y., Nishi, N., Nakamura, T., Hirashima, M., Urashima, T., Oka, T., Futai, M., Mueller, W.E.G., Yagi, F., Kasai, K. (2002) Oligosaccharide specificitiy of galectins: a search by frontal affinity chromatography. Biochim. Biophys. Acta 1572, 232-254

笠井献一先生
1939年生まれ。1962年東京大学理学部生物化学科卒業。同大学大学院化学系研究科生物化学専攻博士課程在学中にフランス政府給費留学生としてパリの生物物理化学研究所で研究に従事。北海道大学薬学部助手、同助教授を経て、1979年より帝京大学薬学部教授、2010年より同大学名誉教授。現在は退官。専門はアフィニティー技術、糖鎖生物学。著書に『アフィニティークロマトグラフィー』(共著、東京化学同人)、『バイオアフィニティ』(共立出版)などがある。
趣味は、アマチュア合唱団で歌うこと、イタリア語、ドイツ語、フランス語を話すこと(オペラ好きのため)。庭に花を植えること。
今回、「探日録」をご執筆いただいた、笠井献一先生の書籍です。
『科学者の卵たちに贈る言葉 江上不二夫が伝えたかったこと』(岩波科学ライブラリー)
- 単行本(ソフトカバー): 128ページ
- 出版社: 岩波書店 (2013/7/6)
- ISBN-10: 4000296108
- ISBN-13: 978-4000296106
- 発売日: 2013/7/6
Amazon™、紀伊國屋書店等の書店にてご購入いただけます。
◆書籍紹介◆
よみがえる江上不二夫の名言の数々。20世紀後半のカリスマ生化学者が説いた江上思想は、今日でも決して時代遅れでもなく、色あせてもいない。むしろ自然科学研究が時代の波に激しく翻弄され、科学研究の原点が霞みがちの今日こそ、一見逆説的な提言はかえって新鮮さがきわだつ。どんな研究に、いかに取り組み、いかに結果に対処すべきか?いくども噛みしめたくなる助言と智恵の宝庫。タイトルは「科学者の卵たちへ…」だが、ベテラン科学者、指導的科学者までもが、大いに鼓舞され、迷いから解放され、勇気をもらえると大好評。読売新聞、毎日新聞、中日新聞、その他のメディアで紹介されている。
◆目次◆
- 他人と戦わない
- 人真似でかまわない
- 伝統を大切にする
- つまらない研究なんてない
- 三ヶ月で世界の最先端になる
- 実験が失敗したら喜ぶ
- 先生は偉くない

