HyperPAGEアプリケーション 2
タンパク質安定性の定量的評価
タンパク質の安定性評価にHyperPAGEを用いた例をご紹介します。ここでは、モノクローナル抗体精製に重要なリガンドであるProtein A誘導体についての安定性を評価し、比較を行いました。
HyperPAGEによるMabSelect SuRe™とrProtein Aの安定性比較
- 手法と材料
- 安定性比較実験の結果
- まとめ
1. 手法と材料
改良型のProtein A誘導体であるMabSelect SuRe™と、通常のリコンビナントProtein A(rProtein A = MabSelect™)のpH安定性を比較しました。
- MabSelect SuRe™とrProtein AをそれぞれCy5/Cy3で標識し、同濃度になるようpool サンプルを調製
- 酢酸・リン酸緩衝液を用いてpHを 7.5、5.0、2.5に調製
- モノクローナル抗体を発現させたCHO細胞培養上清(sup, 1)と、モノクローナル抗体を発現させていないCHO細胞培養上清(sup, 2)を添加
- 37℃でインキュベーションしながら時間ごとにサンプリングし、SDS-PAGEサンプルバッファーを加えて煮沸処理
- PhastSystem™によりSDS-PAGE (20% homogeneous PhastGel™を使用)
- Typhoon™ により蛍光スキャンを行い、得られたイメージをImageQuant™ TLにより定量解析
2. 安定性比較実験の結果
タンパク質間の分解速度の比較
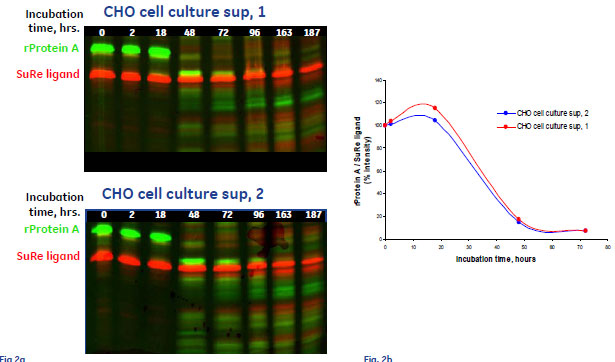
図1 MabSelect SuRe™とrProtein Aの安定性比較 (pH 5.0のとき)
左図: sup, 1(上)/sup, 2(下)条件でのHyper-PAGEイメージ 縦軸:分子量、横軸:インキュベーション時間、緑:rProtein A(Cy3)、赤:MabSelect™ Sure(Cy5)
右図: rProtein AとMabSelect SuRe™のバンド相対強度の経時変化グラフ(レーン左から:0, 2, 18, 48, 72, 96, 163, 187 hrs.)
【結果】
蛍光標識した同量のMabSelect SuRe™とrProtein A CHOを細胞培養上清(sup, 1/sup, 2)にさらし、経過時間ごとにサンプリングしたものを泳動したHyperPAGE画像が(図1、左)です。それぞれの全長タンパク質から予測される分子量に検出されるバンドの蛍光強度の推移から、分解の度合いを評価しました。
このHyperPAGE画像から、rProtein A(緑)の分解が顕著であることに対して、MabSelect SuRe™(赤)では187時間後も全長タンパク質の存在が確認されたため、MabSelect SuRe™の高い安定性が示されました。HyperPAGEでは、このような情報を一目で判別できるというメリットがあります。
また、イメージから得られたrProtein AとMabSelect™ Sureのバンド相対強度の経時変化グラフを示すことで、MabSelect SuRe™の高い安定性を定量的に示すことができました(図1、右)。
※この実験例ではsup,1 / sup, 2の違いは無視して構いません。下記「プロテアーゼ活性条件下における分解速度の比較」をご参照ください。
異なる環境下での分解速度の比較
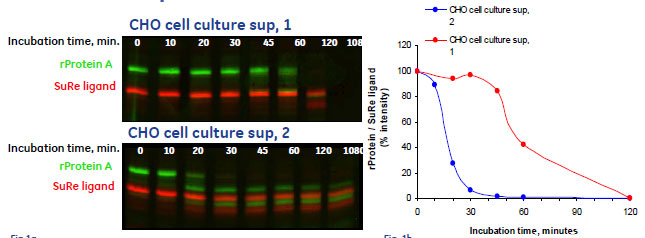
図2 MabSelect SuRe™とrProtein Aの安定性比較 (pH 2.5のとき)
左図: sup, 1(上)/sup, 2(下)条件でのHyperPAGEイメージ 縦軸:分子量、横軸:インキュベーション時間、緑:rProtein A(Cy3)、赤:MabSelect SuRe™(Cy5)
右図: rProtein AとMabSelect SuRe™のバンド相対強度の経時変化グラフ(レーン左から:0, 10, 20, 30, 45, 60, 120, 1080 min.)
【結果】
pH2.5において2つの培養上清(sup, 1/sup, 2)にさらした際の、安定性の変化について調べた例です。
以下のような要因から、CHO細胞内でモノクローナル抗体を発現させているsup, 1条件に比べて、抗体を発現させていないsup, 2条件はプロテアーゼによって分解されやすい環境であることが予測されます。
- 上清へのプロテアーゼ漏洩が多い
- 酸性条件ではプロテアーゼ活性が高まる
- 抗体と結合していないため、露出部分が多い
このような環境下において安定性の比較を行ったところ、rProtein Aが顕著な分解パターンを示したにも関わらず、MabSelect SuRe™では120分以上経過後も全長タンパク質のバンドが検出されました。このことより、MabSelect™ Sureは非常に強いプロテアーゼ活性環境下でも分解速度が遅いことが示され、プロテアーゼ耐性においてもrProtein Aより優れていることがわかりました。
以上のように、異なる分解様式について、相対シグナル強度のグラフ(図2、右)を用いて経時的な比較を行うことや、分解速度の違いを定量的に評価することができました。
まとめ
HyperPAGE(蛍光標識SDS-PAGE)技術を用いることで、目的タンパク質の安定性や分解様式をシグナル強度から定量的に解析することができます。分解進行の経時変化を数値として表すことができるため、ある現象における分解の度合いが正常な範囲であるかの目安の数値設定などにも利用できます。抗体医薬品やタンパク質製剤など、タンパク質の安定性評価に有用な技術といえます。
【補足】MabSelect SuRe™の構造
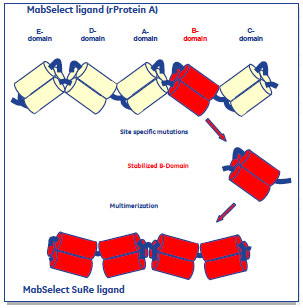 図3 rProtein AとMabSelect SuRe™のドメイン構造
図3 rProtein AとMabSelect SuRe™のドメイン構造
Protein Aによるアフィニティークロマトグラフィーは、モノクローナル抗体精製の標準的な手法として用いられています。
rProtein Aは5つのドメイン(A~E-ドメイン, 図3上部)から形成されていますが、MabSelect SuRe™はその内のB-ドメイン(図3, 赤で示されるドメイン)のテトラマー構造から成ります。その結果、以下のような特性を獲得しました。
- Fab結合領域が欠損させたことで、通常のrProtein Aよりも温和な条件で抗体の溶出ができる
- pHとプロテアーゼに対する耐性が上がり、溶出液へのリガンド(MabSelect SuRe™自身)の混入が抑えられた
MabSelect SuRe™のご注文情報

