DeltaVisionは、難しいことを簡単にできるようにした顕微鏡
DeltaVisionお客さまの声(1/2)

教授 八谷 如美 先生
助教 加藤 大樹 先生
東京医科大学神経生理学講座
八谷如美教授 ご略歴(2013年7月現在)
1995年 九州大学医学系研究院分子生命科学系 博士課程修了
1996年 カリフォルニア大学バークレー校博士研究員
1996年~2001年 科学技術振興機構ERATOグループリーダー
2001年~2005年 科学技術研究機構CREST博士研究員
2005年 東京医科大学神経生理学講座 講師
2006年 東京医科大学神経生理学講座 准教授
2012年 東京医科大学神経生理学講座 教授
神経変性疾患分野、特にプリオンタンパク質に関する研究でご活躍されている八谷如美先生は、ERATO月田細胞軸プロジェクトでご活躍されていた1996年頃からDeltaVisionを使い続けていらっしゃいます。DeltaVisionは、サンプルによっては共焦点顕微鏡に劣らない高解像度画像が撮れ、共焦点顕微鏡よりもパラメーター設定などが比較的平易なため、新入生をはじめ研究室の皆さまにご愛用いただいています。今回のインタビューでは、DeltaVisionをどのように活用して神経疾患のご研究を進めているのか。また、研究者の皆さまなら一度は感じたことがあるセルイメージングにまつわる「これ本当?」という不安をどう克服しているか、そのほかご愛用いただいているポイントを具体的にお伺いました。
正常型プリオンタンパク質が、微小管に沿ってコロコロ移動する様子を観察
プリオン病は、正常型プリオンタンパク質(PrPC)の立体構造が異常型プリオンタンパク質(PrPSc)に変化することで引き起こされます。異常型のPrPScはクロイツフェルト・ヤコブ病に関与することは知られていますが、正常型のPrPCの役割はよく分かっていません。八谷先生の研究チームは、PrPCの生理機能を明らかにするため、GFP融合PrPCを作成し、マウス神経芽細胞腫由来N2a細胞での細胞内挙動を解析されました。その結果PrPCが微小管に沿って局在および移動することが明らかになりました(*1−3)。PrPCが微小管に沿ってコロコロと行ったり来たりする様子は、DeltaVisionで撮影したものです(図1)。
このような微小な対象物の蛍光シグナルを拾うことは、焦点面だけでなく、非焦点面に分布した光の情報も取り込むデコンボリューション技術をもつDeltaVisionが得意とするところです。八谷先生が「DeltaVisionだからこそ、この画像が撮れたのかもしれません」とおっしゃる図1の画像は、原著論文(*1)が掲載された雑誌の表紙を飾りました。
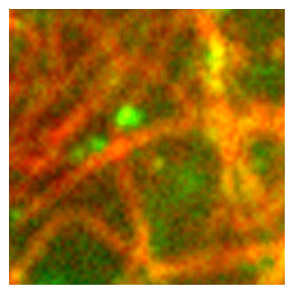
図1. 正常型プリオンタンパク質が微小管に沿って移動する様子
「タンパク質を可溶化するタンパク質」はどこにいる?
八谷先生は「タンパク質凝集をどう解きほぐすか」は、タンパク質の生理機能を明らかにする研究において重要な命題であり、タンパク質の凝集が細胞内にみられる神経疾患の原因究明にもかかわるとおっしゃいます。タンパク質の可溶化剤として尿素や界面活性剤が一般的に使用されますが、解きほぐす効果が十分でない、可溶化剤の混入が次の実験の障害になることがあります。これを解決するため、八谷先生は凝集を解きほぐす分子として、出芽酵母からアンフォルジン(Unfoldin)タンパク質を見出されました。
タンパク質凝集を「解きほぐす」 = 「Unfolding」から命名されたアンフォルジンは、アクチン相互作用タンパク質2 (Aip2p)が10~12個集合して環状の構造をした多量体です。ATP非存在下では環を閉じた状態(Closed state)にあり、ATPが存在するとぱかっと口を開ける(Open state)ように変化します(図2)。アンフォルジンのタンパク質可溶化活性について、Open stateの構造をとっているときに活性が高いこと、アンフォルジンが出芽酵母の出芽時のくびれ(収縮環)を取り囲むように局在している時に活性が高いことが明らかになっています。この局在の様子をDeltaVisionで捉えたのが(図3)です。
アンフォルジンを実際に研究に応用した例として、アンフォルジンを用いたプロテオミクス解析により、Calmodulin-Like Skin Protein がピック病の新たなバイオマーカー候補であることを発表した論文(*4)もご紹介いただきました。現在、大阪大学の共同研究実習センターと一緒に、アンフォルジンを用いて可溶化したタンパク質凝集の中身の一斉同定を試みているそうです。
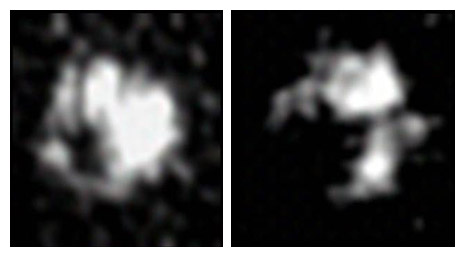
図2. アンフォルジン電顕画像 Closed state(左), Open state(右)
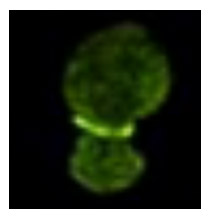
図3. 出芽酵母の周りに局在するアンフォルジンタンパク質多量体
14-3-3タンパク質を中心としたタンパク質凝集や細胞死の機構
プリオン病は、正常型のものが異常型に構造変化を起こすことで発症すると言われてきましたが、ここ10年ほどの間に、正常型プリオンタンパク質が機能を失う、機能変化を起こすなどして、それが神経細胞の細胞死にかかわるのではないかという議論がおこってきました。
そこで、八谷先生方はプリオン病の診断マーカーとして採用されている14-3-3タンパク質に注目し、生理機能解析を行ってらっしゃいます。14-3-3タンパク質は、哺乳類では脳や脊髄で発現が高く、神経細胞中のタンパク質凝集体の形成に関わっており、プリオン病のみならずアルツハイマー病でも診断マーカーになっています。
2013年3月に、14-3-3タンパク質を中心とするタンパク質凝集や細胞死の機構の一端を明らかにした論文、”14-3-3 proteins sequester a pool for soluble TRIM32 ubiquitin ligase to repress autoubiquitination and cytoplasmic body formation”(*5)を発表され、この中にDeltaVisionを使ったデータが掲載されています。CFP-TRIM32と共に14-3-3ηなどのタンパク質を発現させたHEK 293細胞を、1時間ごとに18時間撮影した、光細胞毒性の少ないDeltaVisionならではのライブセルイメージングデータです。
GFP標識した標的タンパク凝集体を生け捕りする
研究内容をご紹介していただく中で、今もっともホットな研究テーマもご紹介いただくことができました。顕微鏡で目の前に見えているタンパク質凝集をそのまま取り出したい、という希望を叶える夢の技術です。
多くのタンパク質実験では、細胞全体をすりつぶし、遠心機でオルガネラやタンパクを分画して、標的タンパク質の多い画分を回収してサンプル調製します。この方法では、どうしても細胞中の正常部分がサンプル中に混入してしまいます。このサンプルを用いて得たデータが、プリオン斑など神経細胞の中に溜まった異常なタンパク質凝集の事実を示しているのか、八谷先生はずっとこの不安を抱えてらっしゃいました。
八谷先生:「市販されているレーザーマイクロダイセクション(LMD)は、直径20μm程度までしか切り出せません。私達の標的タンパク質凝集体は、直径4μm、小さいものだと直径1μm程度です。核より小さいものです。こんなに小さいものをLMDで切り出すのは無理と言われましたが、必ずどこかに方法はあるはず、と探し続けました。そうしたところ、液晶パネルの製造に使われるレーザーが0.2μm程度のものを切り出せることを聞きつけ、これだ!と思いました。私達の研究室で使用しているオリジナルのLMD顕微鏡なら、最小で直径0.5μm程度のものを切り出せます。
LMD顕微鏡の開発やGFP標識したオルガネラを生け捕りにする方法の開発は大変でしたが、なぜここまでこだわったのかというと、一つには、世の中に遺伝性の神経変性疾患に関する遺伝学的な研究は多いけれども、タンパク質からのアプローチは少なく、これに挑戦するためです。二つ目には、形態情報と生化学データを組合せたら、もっといろいろなことを明らかにできるのではないか、そのためには、見たものを見たまま捕ってきて、それを生化学的手法で解析することが必要だと考えたからです。」
この顕微鏡を用いて、GFP標識したオルガネラ等を生け捕りにする方法も開発し、特許を保持されています。また現在、この技術を用いて標的タンパク質凝集体だけを切り取り、アンフォルジンで可溶化して解析されているそうです。
» イメージングにつきまとう「これ本当?」を軽減する顕微鏡

