|
|||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
|||||||||||||||||||||||||
|
Location:Home > 実験手法別製品・技術情報 > タンパク質サンプル調製・前処理 |
|||||||||||||||||||||||||
第1章
|
|||||||||||||||||||||||||
| 由来 | ダイナッミックレンジ | タンパク質種数 | コメント |
|---|---|---|---|
| バクテリア | ~105 | ~103 | タンパク質組成は細菌種と培養条件によって異なります。 |
| 培養用動物細胞 | ~105-6 | ~104 | 培養中の生物学的状態や細胞の種類の管理が不十分であると、複雑性がさらに大きくなります。 |
| 組織 | Increased compared with cell culture samples due to the presence of multiple cell types | Increased compared with cell culture samples due to the presence of multiple cell types | サンプルの特徴は、個々の組織によって、またその組織からのサンプル採取操作の正確さによって大きく異なってきます。一般に、分析の目的を念頭に置きつつ、単離組織の不均一性をできる限り低く抑えることが重要です。 |
| 血漿プラズマ | ~1010-12 | ~106 | 血液は体内の他のすべての組織を灌流し、細胞の大半はタンパク質を循環血中に漏出または分泌すると考えられています。したがって、血漿プロテオームはもっとも複雑なプロテオームであり、体内のすべての器官と組織の健康状態を反映すると考えられます。そのため、バイオマーカーの開発にとってきわめて重要です。 |
| その他血液など | Lower than plasma | Lower than plasma | バイオマーカーの最終目標は血液検査への使用であるものの、血漿は複雑であるため、その開発には他の体液が使用されることが多くなっています。このような体液もきわめて複雑であることには変わりありませんが、それでもサンプル供給源として使用される理由は、特定の疾患に特異的な多くのバイオマーカーは病変が生じた組織で局所的に生じ、病変からの距離が増すにつれ濃度が低下し、血液中に夾雑物があるとこの濃度勾配が顕著に低下するためです。近位体液という用語は、病変部位に近いか直接接触している体液と定義されています(6)。 |
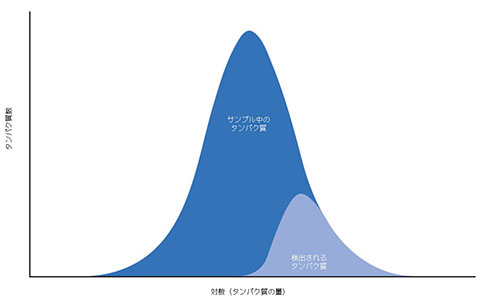
標的を絞った方法で生物サンプル中のタンパク質のダイナミックレンジを低減できれば、タンパク質の検出性が改善されます。しかし、原則として、存在するタンパク質の大半を検出できるのはアフィニティーベースの方法のみです。抗体(または他のアフィニティー結合物質)が存在しない場合、標的を絞った方法を使用するには検出性改善を目的としたサンプル調製の操作が不可欠です。
タンパク質を分解から保護する
タンパク質またはプロテオームのin vivo状態を忠実に反映する情報として、信頼できる分析結果を、組織ベースおよび細胞ベースのサンプルから確実に得るためには、プロテアーゼや他のタンパク質修飾酵素の作用からタンパク質を保護することを検討する必要があります。酵素の制御が不完全であると、タンパク質集団に関するきわめて重要な情報が損なわれるか歪みが生じ、サンプル間の大きなばらつきや誤った結論につながることがあります。原因となる酵素は一般にシグナル伝達や制御されたタンパク質分解に関する細胞内のシグナル経路に関与することから、大半の体液では有害な酵素活性はあまり大きな問題とはなりませんが、例外もあります。血液凝固カスケードはその代表例です。血漿サンプルまたは血清サンプルを作製する場合には十分制御された方法でこのカスケードを避けるかあるいは活性化する必要があります。
上記の酵素系は正常な細胞過程の一部を構成しますが、サンプル調製に欠かせない以下の2つのステップにより、これらの酵素系が有害な活性を示すようになるため、サンプル採取前あるいは中のプロテオームに歪みが生じます。
- サンプル採取(サンプリング)ステップでは、組織サンプルが自然の環境から引き離されるため、組織の恒常性に重大な乱れが生じます。これが分解メディエーターの放出を引き起こし、PTMsに関与するさまざまなプロテアーゼや酵素の活性上昇につながります。培養細胞のサンプリングでも同様のストレス反応が活性化されることがあります。
- in vivo条件下では、細胞タンパク質の多くがタンパク質分解酵素と隔離されています。タンパク質抽出中に細胞および組織の構造が破壊されると、タンパク質が酵素と接触して分解または修飾を受けやすくなることから、in vivo状態の歪みが促進されます。
制御を行わなければ、サンプル調製ワークフロー全体にタンパク質の分解とタンパク質修飾が生じる可能性が存在することになります。しかも、サンプル供給源の種類による大きなばらつきが予測されます。最近、有害な酵素作用はこれまでに考えられていたよりも迅速に生じる可能性があることが示されています。サンプリングから3分後にはすでに広範なタンパク質分解が生じていることが証明されており、脳組織では死後数分以内に数種類のPTMsの濃度が大きく変化します(7)。
タンパク質の網羅的抽出
細胞ベースおよび組織ベースのサンプル供給源は、タンパク質の不均一性が大きく、干渉を引き起こす夾雑物が含まれるため、網羅的抽出(すべてのタンパク質の遊離と可溶化を同時に行うこと)を行うのはきわめて困難です。タンパク質がメンブレンに吸着して他のタンパク質や核酸と複合体を形成すると、抽出プロセスが大きく妨害されます。当然の結果として、抽出されたタンパク質集団はin vivoのタンパク質集団と比較して多少歪んだものとなる可能性が高くなります。抽出プロトコールを最適化してこのような影響を最小限に抑えることは難しい課題であり、一般にサンプル供給源や分析目的が新たに出現するたびに最適化を繰り返す必要があります。
非タンパク質夾雑物の完全な除去
塩、核酸、脂質、多糖、フェノールなどの夾雑物の濃度はサンプル供給源によって大きく異なります(8)。夾雑物が存在すると、サンプル調製手法と分析手法の性能がともに大きく低下する可能性があります。その他の物質、例えばワークフローの一部を改善するために添加される界面活性剤なども、しばしば後続のステップを妨害します。
サンプル調製によるその他のアーチファクトの導入
酵素的分解および不完全な抽出に加え、以下に示すようなプロセスも全体的な感度を低下させ本来のタンパク質分布を歪めるおそれがあります。
- タンパク質溶液の物理的または化学的特性(温度、pH、塩または界面活性剤の濃度など)の意図的または非意図的な変化による沈殿または凝集
- サンプルバイアル、液体吸引チップまたは固相操作器具(クロマトグラフィー担体、フィルター、メンブレン、磁気ビーズなど)への曝露による表面への非特異的吸着
- サンプルの取り扱いに誘発されるタンパク質の化学的修飾(酸化など)の発生
このような影響は、ワークフローに含まれる操作の数と複雑さが増すにつれて大きくなる傾向があります。
お問合せフォーム
※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。
お問い合わせありがとうございます。
後ほど担当者よりご連絡させていただきます。
© 2026 Cytiva