第2章
サンプルの採取、安定化およびタンパク質抽出(7)
抽出例(2)
哺乳動物組織からのタンパク質の抽出(続き)
組織を穏和な条件で破砕して得られたインタクトな細胞集団は、事前に必要なポピュレーションを濃縮してから細胞を破砕することが望ましい場合があります。多くの細胞生物学マニュアルで、機械的破砕方法または酵素消化方法を用いて組織や器官から細胞懸濁液を調製するさまざまな手順が詳しく説明されています(例:文献15、16)。細胞の完全性をあまり損なわないことから、酵素消化方法が推奨されます。さらに、細胞間の接着に関与するCa2+イオンをキレート化する目的で、一般にEDTAを添加します。この方法による細胞の調製では、普通、以下の手法が使用されます。
- Percoll™、Ficoll™などの非イオン性/非浸透性担体の等張密度勾配を用いた分画遠心法。
- 担体流速と遠心力の2つの拮抗する力に基づく懸濁遠心分離法または逆流遠心法 (17)。
- モノクローナル抗体(mAb)結合磁気ビーズを用いた選択的免疫分離法 (18)。
Yeast Protein Extraction Buffer Kitを使用した酵母の酵素消化による溶解
酵素消化により少量の酵母細胞を溶解する方法について以下で説明します。この方法には、弊社のYeast Protein Extraction Buffer Kitを使用します。このキットは、Zymolyaseでスフェロプラストにする調製方法と可溶性タンパク質の抽出に対して独自の改良を加えています。具体的な改良点として、スフェロプラストを調製し、酵母タンパク質溶解・抽出前に溶解酵素Zymolyaseを除去するプロトコールが挙げられます。Yeast Protein Extraction Bufferは、弱い非イオン性界面活性剤を使用した有機緩衝剤と、タンパク質の抽出を促進し安定性を高めるさまざまな塩と添加剤を独自に組み合わせたものをベースとしています。そのまま使用できるZymolyase液もキットに付属しています。使用する分析手法によっては、還元剤、キレート剤、プロテアーゼ阻害剤など他の添加剤をYeast Protein Extraction Buffer Kitと共に使用します(Protease Inhibitor Mixを用いたプロテアーゼ阻害については前述を参照してください)。このバッファーのユニークな組成により、簡単かつ汎用的な方法で酵母タンパク質を抽出できます。Yeast Protein Extraction Buffer Kitでは、ガラスビーズによる酵母細胞の溶解という面倒な手順は必要ありません。このキットは、約10 mlの酵母細胞ペレットを1回で、または数回に分けて処理する場合に適しています。Yeast Protein Extraction Buffer Kitは、酵素アッセイ、一連のクロマトグラフィー手順を用いた分析、ゲル電気泳動など、その後のあらゆる分析手法に適合します。
材料
キットに付属のYeast Protein Extraction Buffer、Yeast Suspension BufferおよびLonglife Zymolyase
β-メルカプトエタノール
前調製
分析手法によってはDTTとEDTAを添加します。使用に適した容量のYeast Protein Extraction Bufferの項を、最終濃度が5 mMとなるようにDTTおよびEDTAを添加して調製します。分析手法にかかわらず、二価金属イオンの存在が必要な場合には、EDTAではなく、他の適切な二価塩を最終濃度5 mMとなるように添加してください。
プロトコール
プロテアーゼ活性の阻害が必要な場合には、プロテアーゼ阻害剤カクテルを添加して抽出時のプロテアーゼ活性を抑えます(Protease Inhibitor Mixの項を参照してください)。
- 酵母細胞の採取
遠心分離により酵母細胞をペレット化します。ペレットをYeast Suspension Bufferに懸濁し、β-メルカプトエタノールを加えます。
- 細胞の懸濁
懸濁液をボルテックスし、4℃で5分間インキュベートします。再度ボルテックスし、均一な細胞懸濁液を調製します。
- 細胞壁の溶解
Longlife Zymolyaseを加え、37℃で30~60分間インキュベートします。
- スフェロプラストの分離
細胞懸濁液を10,000×gで5分間遠心分離します。チューブ内にスフェロプラストペレットが残るように上清を慎重に捨てます。消化した細胞壁の小片は上清とともに除去されます。
オプション:5~10倍量のYeast Suspension Bufferをスフェロプラストペレットに加えます。チューブを静かにタッピングしてスフェロプラストを再懸濁します。上記と同じ方法で再度遠心分離し、上清を捨てます。
- スフェロプラストの溶解
酵母のスフェロプラストペレットをYeast Protein Extraction Bufferに懸濁します。混和し、氷上で30分間インキュベートします。細胞を37℃で1~3分間インキュベートするか短時間の超音波処理を行うと、溶解をさらに促進できます。ゲノムDNAをせん断するには超音波処理が必要です。
ノート:酵母ペレットに対するYeast Protein Extraction Bufferの比が高いほど、細胞溶解が改善されます。
- 抽出されたタンパク質の採取
4℃において20,000×gで30分間遠心分離し、透明な溶解液を採取します。溶解液を次の調製ステップまたは分析に進めます。
ガラスビーズによる物理的な細胞破壊は酵母細胞の溶解に広く使用されている方法です。自家製のRIPAバッファーをガラスビーズとともに使用してS. cerevisiaeまたはP. pastorisからタンパク質を溶解・抽出しました。これらのサンプルならびにYeast Protein Extraction Buffer Kitを用いて調製したタンパク質抽出液の残存タンパク質活性をアリカリホスファターゼアッセイで測定しました。このアッセイでは、基質であるパラ-ニトロフェニルリン酸(pNPP)のアルカリホスファターゼによる変換を経時的に測定します。サンプル濃度について補正した相対活性の平均値と標準偏差を図2.4に示します。両酵素株で、Yeast Protein Extraction Buffer Kitを用いたときの残存タンパク質活性はガラスビーズを用いた従来の方法で得られた結果と同等でした。
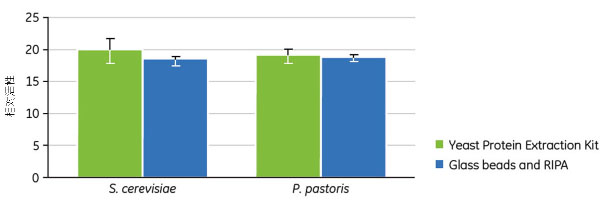
図2.4 自家製RIPAバッファーとガラスビーズまたはYeast Protein Extraction Bufferで調製した酵母抽出液中のアルカリホスファターゼ活性。サンプル濃度について補正した相対活性の平均値と標準偏差を示します。
>>抽出例(3)
タンパク質サンプル調製ハンドブック目次 |2章 References | 略号と用語、記号解説

