
|
|||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
|||||||||||||||||
|
Location:Home > 実験手法別製品・技術情報 > タンパク質サンプル調製・前処理 |
|||||||||||||||||
第2章
|
|||||||||||||||||
| 2-D Protein Extraction Buffer | Composition |
|---|---|
| 2-D Protein Extraction Buffer-I with DILUENT-I, 50 ml | Urea (< 10 M) and NP-40 (< 10%) |
| 2-D Protein Extraction Buffer-II with DILUENT-II, 50 ml | Urea (< 10 M) and CHAPS (< 10%) |
| 2-D Protein Extraction Buffer-III with DILUENT-III, 50 ml | Urea (< 8 M), Thiourea (< 5 M), CHAPS (< 5%), and Amidosulfobetaine-16 (ASB-16) (< 5%) |
| 2-D Protein Extraction Buffer-IV with DILUENT-III, 50 ml | Urea (< 8 M), Thiourea (< 5 M), CHAPS (< 5%), and n-Decyl-N,N-dimethyl-3-ammonio-1- propanesulfonate (SB 3-10) (< 5%) |
| 2-D Protein Extraction Buffer-V with DILUENT-II, 50 ml | Urea (< 8 M), Thiourea (< 5 M), and CHAPS (< 10%) |
| 2-D Protein Extraction Buffer-VI with DILUENT-III, 50 ml | Urea (< 8 M), Thiourea (< 5 M), CHAPS (< 5%), and3-(1-Pyridino)-1-propane sulfonate (NDSB-201) (< 4%) |
| 2-D Protein Extraction Buffer Trial Kit, 6 × 10 ml | 2-D Protein Extraction Buffer-I, -II, -III, -IV, -V and –VI, including DILUENT-I to -III |
これらのバッファーは乾燥粉末ですので、カルバミル化に関連する問題が生じません。使用するサンプルおよび分析手法によっては、酵素阻害剤や還元剤などの添加剤を添加できます(上記の一般的な考慮事項を参照してください)。これらのバッファーは二次元電気泳動に適合しますが、一次元電気泳動など他の分析手法にも使用できる場合があります。2-D Protein Extraction Bufferは、2D DIGE(蛍光標識二次元発現差異解析)の蛍光標識に適合しますが、以下のような例外があります。
- CyDye™ DIGE Fluor minimal dyeを使用する場合には、2-D Protein Extraction Buffer-Iは最適ではありません。標識効率がわずかに低下します。
- CyDye™ DIGE Fluor Labeling Kit for Scarce Samplesを使用する場合には、2-D Protein Extraction Buffer-IIIおよびIVは適していません。標識効率が大幅に低下します。
Extraction Buffer-IおよびIIは大半の分析手法に適しています。しかし、さらに強い可溶化作用が必要な場合には、Extraction Buffer-III、IV、VまたはVIを使用します。
二次元電気泳動ワークフローの例を下の図2.5に示します。
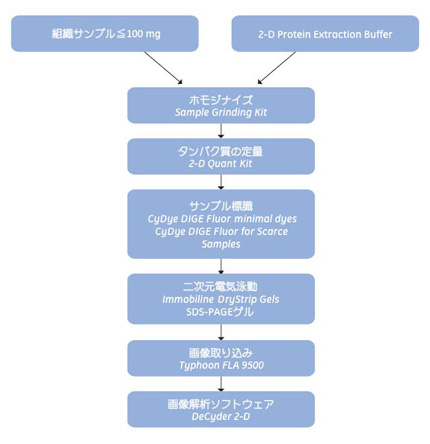
図2.5 2D DIGEを使用して2-D Protein Extraction Buffer-I~VIの抽出能力の差を評価するためのワークフロー
以下の例(図2.6)では、6種類の抽出バッファーのラット肝タンパク質抽出能力を標準バッファーと比較しました。抽出バッファーの大半がminimal dyeに適合し、標準バッファーと比べて高い標識強度を示していますが、Extraction Buffer (EB)-Iは標識効率が低く、CyDye™ minimal dyeを使用する場合にはこのバッファーは適していません。
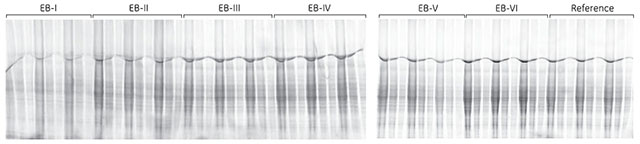
図2.6 ラット肝サンプルを標準バッファーまたは2-D Protein Extraction Buffer-I~VIを使用して抽出しました。その後、タンパク質抽出液をCyDye™ minimal dyeで標識し、ExcelGel™ 8-18を用いて泳動しました。3レーンを1組として、各レーンに20、10または5 μlのサンプルをアプライしました。
材料
2-D Protein Extraction Buffer Trial Kitに付属の2-D Protein Extraction Buffer-I~VI(乾燥粉末)と希釈用液I~III
酵素阻害剤(例:Protease Inhibitor Mix)
バッファー添加剤および他の添加剤(前述の考慮事項を参照してください)
還元剤
前調製
キットに付属の2-D Protein Extraction Buffer-I~VIに規定の希釈用液を5.75 mlまたは5.0 mlを加えて溶解します。規定の希釈用液(使用説明書に従ってください)を対応する2-D Protein Extraction Bufferのボトルに直接添加します。
乾燥粉末ミックス1 gに規定の希釈用液(使用説明書を参照してください)を1 mlまたは1.15 ml添加することで、少量のバッファーを調製することもできます。
還元剤、阻害剤、両性担体(キャリアアンフォライト)、ブロモフェノールブルー染料などの必要な添加剤を加えます。
一定間隔でボルテックスしながら混合し、溶液が透明になるまで室温でインキュベートします。分析手法によってはDTTおよびEDTAを添加します。使用に適した量の2-D Protein Extraction Bufferを、一定の最終濃度(例えば5 mM)に達するようにDTTおよびEDTAを添加して調製します。
プロトコール
プロテアーゼ活性の阻害が必要な場合には、プロテアーゼ阻害剤のカクテルを添加して抽出時のプロテアーゼ活性を抑えます(Protease Inhibitor Mixの項を参照してください)。
- 組織サンプルの採取
- 組織のホモジナイズ
2~3倍量の2-D Extraction Bufferを組織に加えます。Sample Grinding Kitを使用した組織破砕など、適切なホモジナイゼーション手法を用いて組織構造を破壊します。この方法で、組織破壊、タンパク質の可溶化および有害な酵素活性の不活化を同時に行います。 - 2-D Extraction Bufferをさらに加えて、最初のサンプル量の5~10倍とします。よく混合します。
- 抽出液の清澄化
懸濁液を15,000 × gで20分間遠心分離します。ペレットをチューブ内に残して上清を慎重に捨てます。 - タンパク質濃度の測定
弊社の2-D Quant Kitなど、カオトロープや界面活性剤合に適合し、必要であれば還元剤にも適合する方法を用いてタンパク質含量を定量します。 - 二次元電気泳動を行うか、他の分析手法を用いる場合にはワークフローの次のステップに進みます。
タンパク質抽出の代替法としてのタンパク質沈殿
細胞破壊または組織ホモジナイズを行うときに、瞬間凍結させたサンプルをトリクロロ酢酸(TCA)存在下で破砕するなどの方法で、タンパク質を沈殿させて不溶化すると有用な場合があります。主な非タンパク質夾雑物(例:核酸、脂質、炭水化物など)は溶解したままなので簡単に除去できます。ろ過または遠心分離で沈殿物を回収し、タンパク質を適切なバッファーに再溶解できます。沈殿法については、第3章のサンプル中の夾雑物除去との関連で詳しく説明します。
お問合せフォーム
※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。
お問い合わせありがとうございます。
後ほど担当者よりご連絡させていただきます。
© 2026 Cytiva
