第4章
タンパク質サンプル調製ワークフロー内での適合性の確保(1)
はじめに、および使用できる方法の概要
この章では、適合性の確保に使用できる方法を説明します。これらの方法は一般に、分析前の最終ステップにだけ使用するのではなく、ワークフロー全体を通して数回にわたり実施します。また、抗体標識後の過剰な標識試薬の除去やタンパク質精製時におけるクロマトグラフィーステップ間での条件の調節など、他の多くのケースでも使用できます。
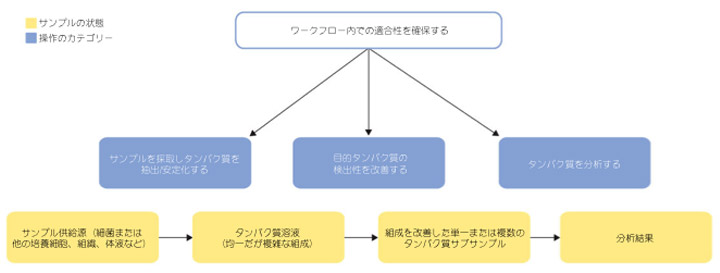
図4.1 タンパク質サンプルの調製と分析の高レベルワークフロー。この章で扱う操作のカテゴリーを枠で囲んで示します。
タンパク質サンプル調製において適合性を確保する手法は、さまざまに分類できます。1つの手法で複数の目的を達成できることもあります。この章では、操作を目的に基づいて以下のカテゴリーに分類します。
- 清澄化
- バッファー交換および脱塩
- サンプルクリーンアップ
- 濃縮/ボリューム低減
主な手法について以下で簡単に説明します。なお、第1章で示したように、各分析手法(ESI-MS、MALDI-MS、二次元ゲル電気泳動など)には夾雑物許容性がありますのでご注意ください。
清澄化
ここでは、清澄化とは、後続のステップでフィルターやカラムの詰まりが生じないように微粒子状物質(細胞片、凝集したタンパク質など)をサンプルから除去することを意味します。微粒子はワークフローの後の段階でフィルターやカラムを詰まらせることがあるため、微粒子除去は不可欠です。細胞片、結合組織、不溶性塩、ダスト、タンパク質凝集物などの微粒子がサンプル調製中に持ち込まれることがありますが、ほとんどの場合、このような微粒子は遠心分離または精密ろ過で除去できます。
■遠心分離
遠心分離ステップの後、可溶化されたタンパク質は上清の中に残り、微粒子状物質は一般に押し固められてペレットを形成します。大半のサンプルについては15,000 × gの遠心力で15分間分離すれば十分です。ただし、粘性が高いサンプルの遠心分離は困難なことがあります。遠心分離は粒子と液体の密度の違いを利用しているため、密度が高い液体の場合、ペレットが形成されないことがあります。水よりも密度が低い脂質や他の脂肪分子は遠心分離後にサンプル溶液表面に浮かぶことがあります。このような場合には、方法を変えることをおすすめします。遠心分離後にサンプルが透明にならない場合には、精密ろ過(下記)を使用します。
■精密ろ過
精密ろ過では、多孔質メンブレンを使用してタンパク質溶液から粒子状物質を除去します。一般に、孔径0.2 μm、0.45 μmまたは0.5 μmのメンブレンを使用し、圧、真空または遠心力を使用して溶液をろ過します。径がマイクロメーター単位の粒子はフィルター上に残るので、ろ液を後続のステップに使用します。
Cytivaは、シリンジフィルター、シリンジレスフィルター(シリンジを必要としない内蔵型ろ過デバイス。図4.2に例を示します)、スピンチューブおよびマイクロウェルプレートを含むさまざまなワットマンフィルターを提供しています。フッ化ポリビニリデン(PVDF)、ポリエーテルスルホン(PES)または再生セルロース(RC)を使用したフィルターデバイスはタンパク質結合特性が低いため、一般に精密ろ過に適しています。微粒子量が多いサンプルの場合、ガラス製プレフィルター付きフィルターデバイス(ワットマン GD/Xシリンジフィルターなど)の使用が必要となることがあります。ガラス製プレフィルターであれば、メンブレンが詰まるまでの時間が長く、多くのサンプルをろ過できるためです。しかし、ガラスはタンパク質と結合する可能性があるため、このようなフィルターがアプリケーションに適しているかを使用前に評価する必要があります。
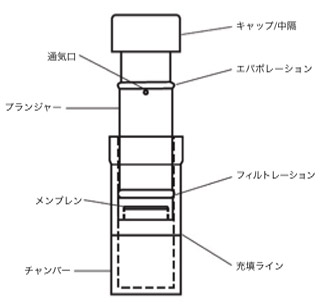
図4.2 Mini Uni-Prepシリンジレスフィルターの概略図
バッファー交換と脱塩(1)
バッファー交換と脱塩は、バッファー系(pHを含みます)の操作とサンプル中の小さいイオン濃度低減を行うステップです。使用できる技術には、ゲルろ過、限外ろ過、膜分離精製、透析、沈殿および固相抽出(SPE)が含まれます。
■ゲルろ過(GF)
ゲルろ過は確立したクロマトグラフィー法で、分子が充填担体ベッドを通過するときにサイズと形状に従って分離されます。この担体は既知の空隙率と設計どおりの不活性特性を持つ(反応性および吸着特性がない)球状粒子で構成されます。低分子量物質のみが球に侵入できるように空隙分布を設計することで、タンパク質と低分子量夾雑物との分離を行えます。バッファーでカラムを平衡化した後、サンプルのバッファー交換と低分子量夾雑物除去を単一のステップで迅速かつ簡単に行うことが可能です。理論の詳細については、Cytivaのハンドブック「Gel Filtration: Principles and Methods(ゲルろ過:原理と方法)」を参照してください。
ゲルろ過を用いた脱塩またはバッファー交換は、バッファー組成の完全な交換が必要な場合に適しています。膜分離精製などの他の手法では、膜分離液を3倍量使用した後の出発サンプル中の化合物の除去率はおよそ95%であり、透析では液を数回交換する必要があります。また、タンパク質沈殿後に得られたペレットには共沈した他の物質が含まれることがあります。
Cytivaは、マニュアルで使用するか、クロマトグラフィーシステムとともに使用するか、ハイスループットアプリケーションに使用することができるさまざまな充填済みクロマトグラフィーカラムおよび96ウェルフィルタープレートを提供しています。これらの製品の多くには、タンパク質からの効率的な低分子量物質除去を可能にするゲルろ過担体であるSephadex™ G-25が使用されています。Molecular Weight(Mr) > 700のペプチドおよび炭水化物サンプルの脱塩にはSephadex™ G-10製品を使用できます。これらの手法の詳細については、Cytivaのハンドブック「Strategies for Protein Purification(タンパク質精製概論)」を参照してください。
脱塩/バッファー交換の手順
CytivaのPD MiniTrap™およびMidiTrap™ G-25カラムは、自然落下または遠心力でそれぞれ最大0.5 ml、1.0 mlのサンプルを脱塩できます。これよりも少量の100~180 μlのサンプルについては、PD SpinTrap™ G-25スピンカラムと微量遠心機を使用するか、PD MultiTrap™ G-25 96ウェルプレート(サンプル量70~130 μl)と遠心分離を使用して、複数のサンプルを同時に脱塩できます。真空法でPD MultiTrap™ G-25を使用することも可能ですが、遠心分離法に比べて再現性が低下するため推奨しません。PD SpinTrap™ G-25の手順と略図(図4.3)を以下に示します。PD MultiTrap™ G-25は、遠心機を搭載したTecan™ Freedom EVO™などの一般的な自動液体処理システムに使用できます。スクリーニングを目的としたPD MultiTrap™ G-25によるスループットの改善については、第5章を参照してください。
材料
PD SpinTrap™ G-25カラム
平衡化バッファー:適切なバッファー
前調製
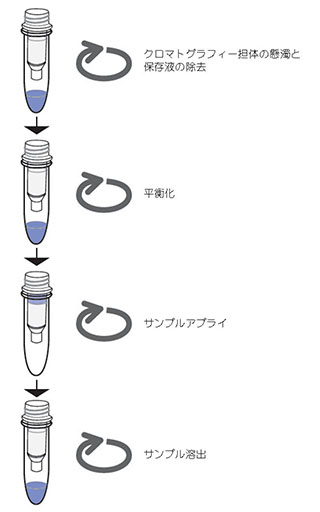
図4.3 PD SpinTrap™ G-25のフローチャート
プロトコール
遠心操作に関する詳細については製品使用説明書を参照してください。SpinTrap™カラムは標準的な微量遠心機の大半で使用できます。
- クロマトグラフィー担体の懸濁と保存液の除去
カラムをボルテックスし、800 × gで1分間遠心分離します。
- 平衡化
500 μlの平衡化バッファーを加え、800 × gで1分間遠心分離します。これを4回繰り返します。
- サンプルアプライ
100~180 μlのサンプルを充填済みカラムの中央にアプライします。
- サンプル溶出
800 × gで2分間遠心分離して溶出します。
>>バッファー交換と脱塩(2)
タンパク質サンプル調製ハンドブック目次 |4章 References|略号と用語、記号解説

