
DIGE 道場 第3回
できるプロのタンパク質抽出術
第3回 もくじ
- はじめに ~とってもDIGE(大事)なタンパク質抽出~
- タンパク質可溶化液について
- 培養細胞からのタンパク質抽出法(本ページ)
- 組織からのタンパク質抽出法
- おわりに
Dr. 近藤のコラム
 コラム第3回 「生涯道場編」 ~戦うプロテオーム研究~ コラム第3回 「生涯道場編」 ~戦うプロテオーム研究~
3. 培養細胞からのタンパク質抽出法
●ポイントさえ掴めば培養細胞は簡単!
培養細胞はタンパク質抽出の点からはもっとも簡単な素材である。臨床検体と違って無限にサンプルを得られるので実験系を立ち上げる際やラボ間の標準化のコントロールとして使える(そのようなサンプルを必要とされる方は筆者までご一報いただきたい。サンプリングにはいくつかの工夫が役立つ。
まず、細胞の状態だが、単層培養の培養細胞の場合、オーバーコンフルエントになった細胞からのタンパク質抽出は間違いなく失敗する。具体的には、DNAを多く含む粘調なサンプルになってしまう。細胞をうすくまいて3日後くらいの、まだシャーレの底が見えるくらい(80%コンフルエント程度)に細胞が増えたときにタンパク質抽出を行う。コロニー状に密集して増殖する細胞もあるのだが、完全に密集してシャーレいっぱいにならない限り問題ない。
もう一つのポイントは、タンパク質抽出の前に細胞を10%TCAで固定するというものである。TCA固定によってタンパク質は沈殿する一方で、細胞の膜はぼろぼろになり、細胞内のフリーの脂質などはすべてTCAに溶け出す。同時にタンパク質分解酵素の活性も極端に低い酸性条件によって抑えられる。次に過剰なTCAを除去し、高濃度のウレアを含む可溶化バッファーですばやく細胞を処理する。この操作で培養細胞からのタンパク質抽出はまず例外なく問題なくうまくいく。
培養細胞からのタンパク質抽出法
- セミコンフルエントの細胞を用意する。
- 培地を捨てて冷やしたPBSで細胞を洗い培地に由来する血清タンパク質をできるだけ全部除去する。加えるPBSの量は適当なので、ピペットを使ったりせずデカントでバサッと入れてと入れてバサッと捨てる。この段階までは細胞を氷上に置かない。コールドショックタンパク質の誘導を避けるためである。ぎりぎりまでCO2インキュベーターに入れておくのが理想的。浮遊細胞の場合は遠心して細胞を集め、以後は同じ操作を行う。
- 冷やしておいた10% TCAをシャーレに十分満たしすぐに氷上に30分間静置する。室温が高いと静置している間に氷が溶けてきてシャーレが傾き、10% TCAに浸らない細胞が出てくると困るので、10% TCAはけちらないで十分入れる。
- 30分間、氷上で静置。
- 10%TCAを100 µl以上残して捨て(残す量は適当)、スクレーパーで細胞をかきとってエッペンドルフチューブに入れる。かきとるときシャーレを回しながら、10% TCAの「たまり」の中で細胞を回収するようにするのが回収率を上げるコツ。液体(TCA)がないところで細胞をごしごしこすらない。全工程を通じて細胞は「消しゴムのカス」のようになっているが気にしない。
図1 スクレーパーでかいたあとの細胞
白い消しゴムのカスのように見えるのが細胞。残したTCAの量はちょっと多めだが特に問題はない。
- 3,000回転、10分。回転数、時間は適当だがあまり激しく遠心すると後で細胞がほぐれなくなる。
- 上清を捨てる。このときペレットは固まっていることが多いが、あまり悠長に作業をしていると壁にへばりついているペレットが崩れてくるので急ぐ。
- 冷やしておいたPBSを入れてペレットをほぐす。ほぐすと言ってもがんがんピペッティングするのではなく、いきおいよく入れてペレットがエッペンドルフチューブの壁からはがれる程度で十分である。この操作の目的は過剰なTCAを除去することである。あまり洗いすぎるとせっかく固定した細胞がもとに戻ってしまう。逆にTCAが残りすぎるとあとでpH調整がうまくいかない。
- 3,000回転、10分。この回転数も適当なのだがとくにこの条件を守らない理由もないのでこのままをお勧めする。
- 上清を除く。この遠心終了時には壁にへばりついているペレットは崩れやすくなっているため、上清の除去は急ぐ。サンプルが複数あって1本目と12本目で時間差ができるようなときはペレットがどうしても崩れてしまう。エッペンドルフチューブの向きをそろえることである程度は防げる。崩れてしまったらもう一度遠心を行う。
- 上述のタンパク質可溶化液を加える。ペレットとして固まりになっている細胞塊をばらばらにするように、タンパク質可溶化液を勢いよく加えてすばやくピペッティングすることがポイント。ここは重要。
- 氷上に30分間静置する。
- 15,000回転、30分。
- 上清を回収する。10 cmシャーレから実験をスタートすると、使いきれないほどタンパク質が回収できるので、ペレットぎりぎりまで上清を回収する必要はない。このときDNAのためにサンプルが粘調になっていなければサンプリングは成功。普通はさらさらしたサンプルになっている。粘調度にもよるが、あきらかに粘度が高い場合は、自分ならやり直す方を選ぶ。
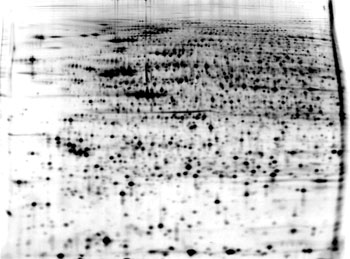
図2 膵がん培養細胞の二次元電気泳動画像
この画像上のスポットに対応するタンパク質についてはGeMDBJ Proteomics に登録・公開されているので参照されたい。現在1,100個以上のタンパク質スポットについてアノテーション情報を公開している。
次へ 4. 組織からのタンパク質抽出法
このページのトップに戻る
DIGE道場トップページへ
お問合せフォーム
※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。
お問い合わせありがとうございます。
後ほど担当者よりご連絡させていただきます。
|

