
東京大学大学院
医科学研究所
津本 浩平 先生
対談:アフィニティーを測定する際の濃度測定はどうする?
Cytivaで分子間相互作用解析のコンサルティングを担当しているK.太蔵は、お客さまからこんな質問をいただきました。
アフィニティーを測定する際には濃度を正確に決定しておく必要があると思いますが、実際にはどのような手法、方法論で濃度を決めるのがよいのでしょうか?例えば、低分子化合物やペプチドであれば濃度の定量は容易だと思いますが、タンパク質であればそう簡単ではないと考えられます。いろいろなタンパク質濃度の定量法が存在しますが、通常の方法では、単に可溶性の総タンパク質量がある程度求まるだけであって、その中にどの程度アクティブなもの(変成していないもの)が含まれているかは別途検討する必要があるはずです。しかしながら、論文で用いられているタンパク質量というものには、このことをさして考慮せずに~µM使用した、などと記述したものが多くあるように思います。
(福岡大学 CAR様)
正確なアフィニティーを測定する上で、アナライト濃度の正確な算出は非常に重要です。しかし、通常のタンパク質定量法においては、可溶性の総タンパク質量を求めるにとどまっています。
相互作用解析の実験で、本当にそうした定量法で十分なのかどうか大いに困ったK.太蔵は津本先生はどうされているのか、聞きに行ってみることにしました。津本先生の回答やいかに。今回は津本先生(以下、 のアイコン)とK.太蔵(以下、太蔵)の対談でお送りします。
のアイコン)とK.太蔵(以下、太蔵)の対談でお送りします。
タンパク質の活性の定量
- 太蔵:私が認識している中では、相互作用測定をする前に、タンパク質の活性を定量的に評価している人はほとんどいないと思うのですが。
- :うん、いない。
- 太蔵:実際、測定に用いるタンパク質が100%活性を保っていると仮定してアフィニティーやカイネティクスを算出している方がほとんどだと思いますね。でも、Biacore™を用いて真のアフィニティー、カイネティクスを求めるには、測定に用いるタンパク質が何%活性なのかを知ることは、非常に重要だと思います。活性タンパク質の量を正確に求めた上で実験することにより、アフィニティーの結果がこれだけ変わります。
-
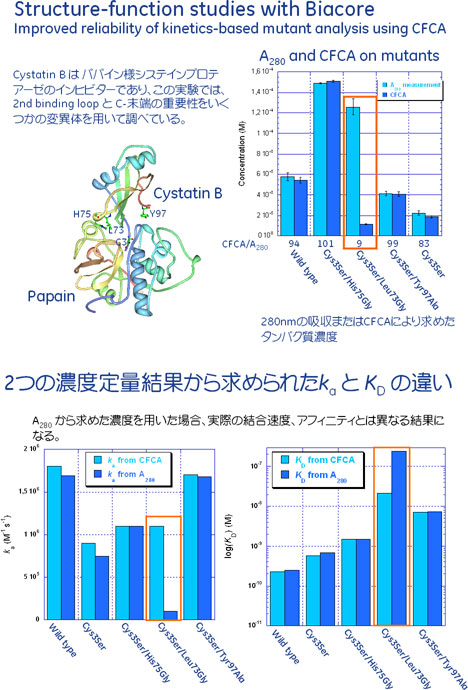
拡大
- 太蔵:Biacore™では最近、"アクティブコンセントレーション"という表現を用いて、アナライトタンパク質の活性型の割合を測定する手法を提案しています。
Biacore™を用いた濃度定量
検量線を用いた定量
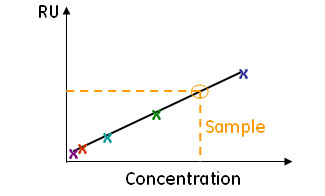
- スタンダードサンプルで作成した検量線に対して、サンプルのレスポンスを
- スタンダードサンプルがあるものに対して有効
CFCA(Calibration-free concentration analysis)
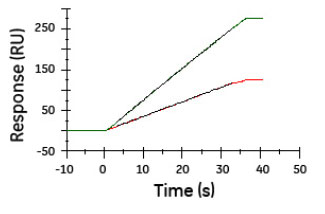
- サンプル添加時の結合量(速度)によって濃度が算出される
- スタンダードサンプルが必要ない
- スタンダードサンプル自身の評価にも有効
- :最近出たやつだね、新しいシステムに入っているよね。(Biacore™ T100、X100 Plus Package Ver. 2)
- 太蔵:はい。それは、キャリブレーションフリーコンセントレーションアナリシス(CFCA)という機能を使って測定できます。CFCAはマストランスポート条件下でのセンサーグラムの立ち上がりの傾きから求めることができます。
- :スタンダードは必要ないの?
- 太蔵:はい。これは検量線を作らずに濃度を算出できます。
- :どういう原理で?
- 太蔵:センサーチップ表面をマストランスポート条件にしてやり、結合反応を拡散律速にしてやります。その上で、拡散速度と濃度の相関関係から結合活性を持ったアナライトの濃度を算出します。
- :それは面白いですね。いわゆる逆手っていうやつですね。
- 太蔵:この前のバージョンアップでこちら(津本先生のお部屋)の機械には入っています。
- :今後重要になるでしょうね。
ITCとSPR
ITCとSPRを使った活性定量法
- 太蔵:ITCでは、どのような考え方で実験を進めていきますか?ITCの方の評価の仕方が僕はまだあまり経験がないので。
- :基本は同じですよ。あとは結合エンタルピーの値が変わるんですよね。タンパク質の構造が若干崩れていると、結合にフォールディング伴うでしょ。フォールディング時の非共有結合形成に伴う発熱が増えますよね。だから、エンタルピー変化の大きさを見て、ちょっと部分変性が始まっているね、という議論はします。ただ、それはエンタルピー値の絶対値が正しいという前提なので、今は皆あまりいっていませんね。どちらかというとn(ストイキオメトリー)なんですね。抗体の場合は分子が大きく複雑なので、変性するとエンタルピーの値が変化するというよりは完全に失活するのでストイキオメトリーがずれる。抗体の場合はこれでいいんです。
ITCを用いたタンパク質の活性予測
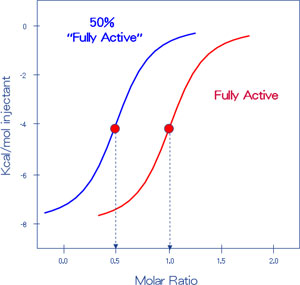
ITCにおいて、分子Aと分子Bの相互作用が1:1での結合反応である場合において、分子Aのうちの50%が完全に失活している場合、シグモイド曲線の傾きはまったく同じで、結合比のみが変化した結果が得られます。このような結果を元に、この場合は分子Bが50%失活しているのではないかという考察を行う場合が多くあります。
- 太蔵:完全にストイキオメトリーだけがずれるのですか?
- :そうです、ほとんどそうです、タンパク質の分子構造が硬い場合はね。ですけど、わりとぐにゃっとしたタンパク質でいろんな構造を取り得るとか、フレキシブルなドメインが相互作用でパッキングできるようなものっていうのはエンタルピーの増大を伴います。要するに結合部位が残っていれば結合するでしょ。ITCはそうしたインターラクションに伴って発生するすべての熱を測定することになるから、非変性タンパク質と部分変性タンパク質で結合のエンタルピー変化の値が変わるんですよね。
この考察は特に抗原側の評価で我々はよくしますね。
抗原と抗体だったら抗原側の崩れがエンタルピー変化に出るんですよ。2ヶ月前とかに合成したタンパク質で、nのズレと共にエンタルピーの値もずれるから、いったいどうしたのということはありますね。
- 太蔵:そうか、そういう意味ではBiacore™のアクティブコンテントレーションアナリシスは基本的には結合だけを見ることができますね。
- :部分変性を伴う場合はBiacore™方がより正確な値を見ることができるという理解ですね。
- 太蔵:濃度定量ではBiacore™がたぶん正確ですね。
- :濃度定量ではそうですね。ただ、Activeかどうかを議論するには、やはり2つを併用した方がいいでしょうね。要するにエンタルピーの値が変わったとしてもActiveということに変わりはないでしょ。Nativeかどうかっていう議論も、何がNativeかってことがあるので。そこは難しいところですね。
一般論として議論するときはストイキオメトリーはITCで、濃度はBiacore™で見るというのがベスト。そうすれば、Inactiveの濃度も測定できてしまうので。ある意味。この2つの方法を組合せるというのがいいですね。
- 太蔵:そうですね。Inactiveのものも熱として反映されてしまう可能性があるからですね。
- :だから複数のものを組合せた方がいいということですね。
ITCだけで絶対そうとはいえない。SPRもそうなんですけど、クロスバリデーションというか、いくつかの方法を自分で準備しておいて絶対こうですということを、裏付けとして示しておかないといけないということはあると思いますね。
相互作用解析における活性定量の必要性

左:津本 浩平 先生
右:Cytiva、K.太蔵
- 太蔵:このご質問の趣旨としては、相互作用を測る前に活性を評価しておいた方がいい。
- :しておいた方がよい。特に酵素の場合はね。
Protein Interactionそのものを見る場合はエンタルピーがやはり一番わかりやすいですよね。そのときにできる非共有結合の数を反映するので、わかりやすいんですね。ですけど、どれがスタンダードかちゃんと決めておかなければならないので。この趣旨の一番本質はある特定の溶液の中にいろんな分子種が混じっていて、そいつらが混じっているときにどうやってActiveのものをどれくらい定量できるのか、っていう問題ですね。
それはスタンダードをきっちり作るという従来法のやつですね。
- 太蔵:スタンダードというのは。100%活性があるものということですか?
- :100%活性があるということを、酵素だったら酵素活性をちゃんと見た上でKon、Koffはどうですか、エンタルピー、エントロピーはどうですか、という見方をした方がよいということだと思いますね。
正確な濃度決定というのは、別の方法をちゃんと持っておいたほうが良いということでしょうね。例えばローリーやブラッドフォードという方法はあくまでもペプチド結合量(アミノ酸の鎖としてのタンパク質の量)を見ているだけなので、Activeなものをみるという方法を複数持っておいたほうが良いということですね。
- 太蔵:最初におっしゃっていたようにITCとBiacore™の結果を見ながら判断する、考察していくということは皆さんができることだと思うのですが、その前段階として別の方法で定量的に活性を評価できるといいですね。
- :活性を定量しておく方法があることがベターですね。もしそれがなければやはりこの2つの方法を組合せるということだと思いますね。僕らも1つだけでは不安なので必ず複数やりますので。
例えば、蛍光スペクトル取るとか、CD取るとかやってきています。でも、最近は皆さんバイオの人はあまりやらないので。
- 太蔵:そうですよね。
- :僕らだとスタンダードにやりますけど。そうじゃない人はCFCAで見るというのが現時点ではベターなんだと思いますけどね。
- 太蔵:タンパクの場合、ほとんど100%活性を持っている標品を持っているのは難しいので。
- :難しい、難しいです。100%活性を持っていると仮定して議論する場合が多いですね。
実際は、1割はInactiveだったりすることがあるのですけど、とりあえず論文で書いているときは、何µM使用したときにこういうデータになりました。nは0.9でした、という書き方でとりあえず議論しますね。たいがい0.9となっているときは本当にActiveなもののInteractionというよりは1割くらいちょっとおかしいのが混じっているという風な見方をしますね。
- 太蔵:そこはもう論文の考察に可能性として不活性型があるというのを含ませるのですよね。
- :論文の考察に含ませる場合が多いですね。
- 太蔵:まだ活性型のタンパク質濃度測定に王道はないということですね(笑)。
- :王道はないですけど、かなり信頼性のある手法が開発されてきているということですね。それがCFCAのような手法だということですね。
- 太蔵:まだ、CFCAはご評価されてないかと思いますが、どう思われますか? 。
- :いや、これは有力ですよ。
- 太蔵:実ははまだ、世の中で広く認知されていないですが。
- :ま、それは宣伝と、価格の問題ですよ。実験結果を出して、すごく使えますよということをアピールしていくしかないですね。
- 太蔵:たぶん、こういう観点で実験されている方はそこまで多くいない。気づいている方は多くないと思っています。
- :ご質問をいただいた先生はおそらく生化学で、かなりそういうことをまじめに考えられる方だと思うので、気づかれている。やっぱりActivityが絶対なのですよね、僕らにとっても。だけどActivityが100%だっていうのは、何をもって100%かというのはすごく難しい。生化学の人が思うのと同じように。
こういう場合も正確にこれが100%間違いなくこうですというのはなかなかないのでいくつかの方法を組合せてやるしかない。
こういう場合もそうだし、実際のタンパク質の治療薬の品質管理も皆な同じで、1つだと不安だからA法、B法、C法、D法、E法と、だーっと並べて、だからOKですよ。これくらいの誤差の範囲内に収まっていますという議論を実際にするので同じだと思います。どれかの方法がおかしいというのは過去の議論で、今はこの方法だとこうでした、あの方法はこうでしたという議論をするべきだと思います。
- 太蔵:そこから総合的に判断して、このサンプルは活性が何%くらいありそうだと予測するのが王道だということですね。
- :そういう言い方をすることがベターだと思いますね。あくまでもアフィニティーというかActivityを求める、今までやられてきた簡便な方法があれば、それをベースにとりあえず定量した上で他の方法を使うということがベストだと思います。
- 太蔵:例えばタンパクが1mMだったとして活性を計ったときに、これまでの経験からすると活性がこのくらいあるはずなのに、今回すごく低いなという、そういう経験値なんですよね。
- :Biacore™の場合は、経験的にはRmaxの値が下がっていくというのがわかるでしょ。それは実際そうなんですよ。Rmaxが下がってきているからチップの表面にいるものはInactiveに変性してきているということが定性的にはわかってきているわけですよね。それを実際は絶対として証明するというよりは、10回の測定するとRmaxが2/3になりました。だから1/3は変性してますね、おそらくしてると思います。という事例を増やしてこういうものですと私たちが提案していくべきだと思っています。現状では私はRmaxというのは非常に状況を反映している値だと思っています。
- 太蔵:チップ上のタンパク質に関して、ですよね。
- :チップ上のタンパク質に関しては、そう思います。だから、何回も測定しているうちにRmaxがずれていくというのは決してネガティブではなくて、やっている間にタンパク質が変性するという事象を示しているだけです。だからRmaxの変化の値をきっちり評価しながら解析する姿勢が大事だと。Rmaxがおかしくなるからダメと捨てるのではなく、ちゃんと正確に求められているところのデータを持って、相互作用を議論するということが大事だと思います。
- 太蔵:そうですね。逆に固定化していないアナライトの方は、まさにCFCAで評価できます。これは新しいBiacore™の技術なんですけど。これでアナライト側の活性体の量を算出できる。
- :その組合せですよね。固定化している側はRmaxでアナライト側はCFCAで。
結局、この手の考え方は、例えばタンパク質治療薬だとかタンパク質を薬にするとか材料にするということで品質管理の場所でこの問題がすごくクローズアップされてきているのですよね。この先生のご質問というのは古くて新しい指摘で、昔からBiacore™の表面に固定したらほとんどタンパク質死んじゃうじゃんみたいなことは、よくいわれます。でもそれは経験的にRmaxという値が出てきて、条件を設定してマストランスポートの問題が解消されている領域内であれば非常に正確に求められるということになったので、皆が安定に使うようになってきてるのですよね。
エンタルピーの話も同じで、何はともあれその相互作用でAとBがであったときに出るすべての熱を合わせるとこうなるということに関してはコンセンサスが出て、結果として現状では熱量測定では正確な値が出るという結論なので、現状ではこの2つの組合せるというのがいいということになるのですよね。あとはActiveかInactiveかということに関しては、これだけではなくて、別の方法を組合せるということがベストと思います。
- 太蔵:タンパク質によってアッセイ系が違いますよね。
- :そうそう、そのアッセイ系をきちんと確立するということだと思います。実際に分子の構造が完全に正しくても、活性がない酵素っていうのはたくさんあるので、何をもってNativeかとか何をもってActiveかという指標をきちんと見ておかないといけないので。これはある意味、生化学の基本だったりするので。
- 太蔵:実際、このITCのn(ストイキオメトリー)で濃度を評価されている方が結構いらっしゃるときくのですが。
- :うん。品質管理でこれ使えるのではないかということで、表にはそんなに出していないんですけど、データをとっている人はいると思います。抗体とか硬いタンパクに関しては、nがずれるだけで済むので。問題は、最近はやりのいろんなコンフォーメーションをとる分子の場合に、発熱量がずれる場合があるので、そこのときの解釈の問題があるのですね。ストイキオメトリー変化が中途半端だという問題はあるんですね。
でも、今、普通に世の中に出るようなタンパク質の薬とかというのは、このずれがかなり大きな指標になると思います。
ようするに崩れちゃうと変性して、もうInactiveになるわけですね。
- 太蔵:活性が完全に0か100ということですね?
- :0か100ですね。逆にシグナル伝達系なんかの場合だと構造がぐにゃぐにゃになったりするので、エンタルピー側の値が変わったりするということあって。だから何がActiveか、何がスタンダードかということを正確に自分で決めた上で値を出すということと。あとは、一番早いのは、即座に活性が落ちる変異体を作って比較するというデータに使うということも重要なんですよね。
最初から活性が落ちるものを用意して、同じように分析を走らせて、野生型と変異体を比べるみたいなことは必用です。実際それに関してはこの2つの方法は非常に強いので、ITCもBiacore™も。
- 太蔵:クリアに理解できました。ありがとうございます。







