|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Location:Home > 実験手法別製品・技術情報 > BIA(生物物理学的相互作用解析) > 相互作用解析の王道 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
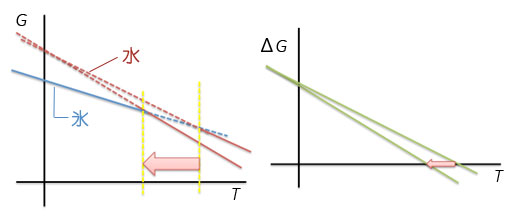
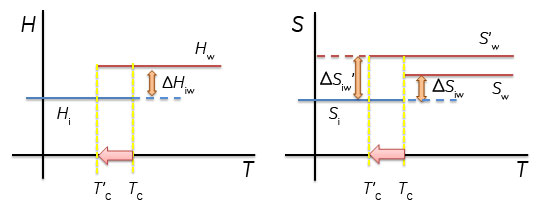
DSC(示差走査熱量計)によるタンパク質の熱安定性評価(1)大阪大学大学院工学研究科生命先端工学専攻 タンパク質の熱変性の説明を行う前に、タンパク質の熱変性を理解する際に助けとなる幾つかの熱力学的な説明を最初に記述します。 1.自由エネルギーと状態について ~H2Oの相転移を例として~2つの状態の間に自由エネルギー差がある場合、エネルギーが低い状態に系は移ります。例えばH2Oの場合、氷点である0℃より高く沸点である100℃より低い温度では、氷よりもエネルギーが低い水として存在し、0℃より低い温度では水よりもエネルギーが低い氷として存在します。0℃では水と氷のエネルギーは等しく、そのため2つの状態が共存することができます。 Gi=Hi-TSi (1) Gw=Hw-TSw (2) ここで、Gi、Gwは氷と水の自由エネルギー、Hi, Hw, は氷と水のエンタルピー、Si, Swは氷と水のエントロピーです。氷と水のエネルギー差(ΔGiw)は、氷と水のエンタルピー差ΔHiwおよびエントロピー差ΔSiwを用いて ΔGiw=(Hw-Hi)-T(Sw-Si)=ΔHiw-TΔSiw (3) となります。 ΔHiw=TΔSiw (4) この式(4)は氷から水に相転移する際にはエンタルピーとエントロピーが変化することを意味します。
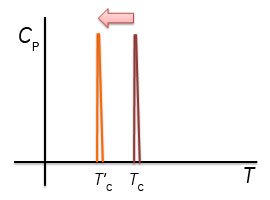
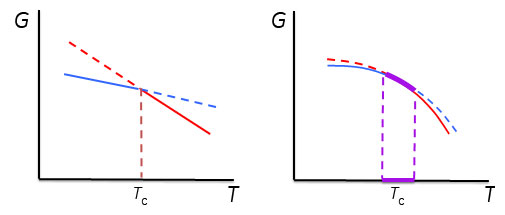
2.熱容量の測定とエンタルピー変化ここで、1 gの氷を-20℃からヒーターを用いて加熱して温度上昇させた場合を考えます。氷の比熱は2.09 J/gKなので、2.09 Jを加えると1℃温度が上昇します。0.209 WのヒーターであればW=J/sであるから、10秒間電流を流すと1 Jの熱量(dQ)が氷に加わることとなります。このようにして氷や水を1℃温度上昇させるために必要な熱量である熱容量を測定することができます。圧力一定の条件であればdH/dT=CPであるから、熱容量を温度で積分することで系のエンタルピー変化が得られます。氷を加熱した場合、0℃になると温度上昇が止まり、更なる熱の投入が必要となり、実験的には0℃で大きなCPのピークが観測されることとなります。∫ CpdT=dHから、このピークを積分した値が式(4)のΔHiwに相当します。このΔHiwは氷が水に相転移する際のエンタルピー変化です。ΔHiwを転移温度(氷から水への転移の場合、273.15 K)で割った値がΔSiwとなります。 溶液の安定性について検討する際、溶液全体の自由エネルギーとして把握する必要があります。たとえば、塩などを添加した際の水の凝固点降下を理解するためには、水の安定性として捉えるのではなく、塩が水溶液中に溶解した塩溶液の安定性として理解する必要があります。2つの状態のエネルギー差ΔGが0となる温度は、塩の添加などにより水溶液のエネルギーが変化すれば変化します。例えば、図1に示したように、水溶液相のエントロピーが大きくなると相転移温度は低下します。
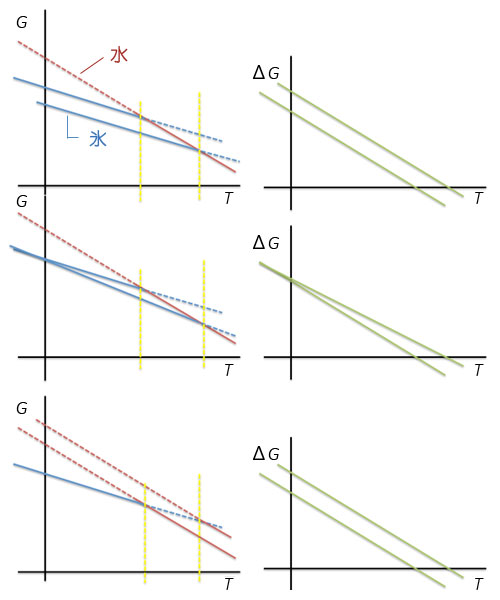
他に、転移温度の変化へとつながるパターンを図3に示しました。いずれもどちらかの相のエンタルピーまたはエントロピーが変化することでΔGが等しくなる温度、つまり、相転移点が変化します。
3.タンパク質の熱安定性の概要通常、生体内で機能を発揮するタンパク質は特定の立体構造をとっていますが、温度の上昇など周囲の物理的環境やpHの低下や変性剤の添加などの化学的変化により変性します。タンパク質溶液の温度を上昇させると、タンパク質の熱変性に伴って吸熱反応が観測されます。こうしたタンパク質の熱変性も以下の点に留意すればH2Oの相転移と類似の考え方で理解できます。
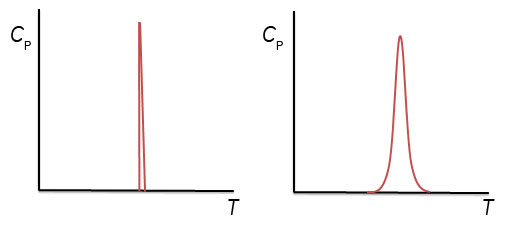
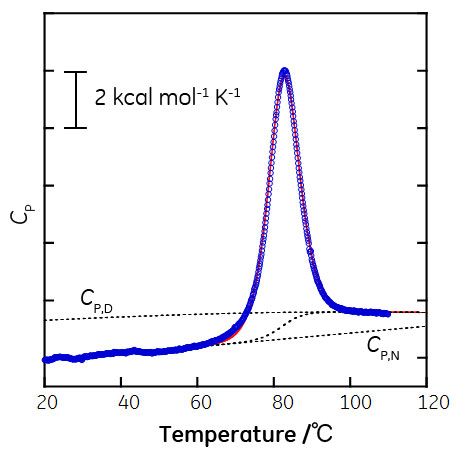
3. に記載したように、タンパク質は熱変性前後で相分離しないことから、タンパク質の熱変性を相転移と呼ぶのが相応しいか検討の余地がありますが、過熱現象や過冷却状態といった状態が観測されることから、本稿では、相転移として捉えた場合の説明を行います。また、変性したタンパク質同士が凝集し、沈殿形成など相分離を起こすことがありますが、こういったケースは平衡論だけでは理解が困難なため、今回は取り扱わないこととします。 天然状態のタンパク質は温度の上昇に伴い変性状態へと変化します。この過程を示差走査熱量計で観測した結果が図5です。ここで縦軸はExcess heat capacityとよばれ、リファレンスセルに投入した溶媒とサンプルセルに投入したタンパク質溶液との熱容量の差に対応します。
この場合、60℃以下では大部分が天然状態をとり、60℃から100℃の間で変性が起こり、100℃以上では大部分が変性状態をとります。変性に要したエンタルピーは∫CPdTにより得られ、カロリメトリックエンタルピー(ΔHcal)とよばれます。ここで、天然状態のエネルギーが下がるか、変性状態のエネルギーが上がれば、天然状態と変性状態のエネルギー差が大きくなり、変性温度は上昇します。そして、氷から水への相転移と同様、天然状態のエネルギーが下がる場合、天然状態のエンタルピーが小さくなるか、あるいは天然状態のエントロピーが大きくなる、のどちらかまたは両方が同時に起こるケースが考えられます。 「相互作用解析の王道」について「相互作用解析の王道」は、2009年8月よりバイオダイレクトメールでお届けしています。
バイオダイレクトメールは弊社WEB会員向けメールマガジンです。バイオダイレクトメールの配信をご希望の方は、下記リンク先からご登録をお願いいたします。 関連リンク津本先生の研究内容や論文などはこちら→津本浩平先生の研究室Webサイト お問合せフォーム※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。 お問い合わせありがとうございます。 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
© 2026 Cytiva