|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Location:Home > 実験手法別製品・技術情報 > BIA(生物物理学的相互作用解析) > 相互作用解析の王道 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
抗体医薬リードのカイネティクス評価手法の実例エーザイ株式会社 エーザイ・プロダクトクリエーション・システムズ はじめに抗体医薬品の生物学的活性評価においてはICH Q6Bガイドライン(生物薬品の規格及び試験方法の設定)が国際的基準として制定され、製剤の特性解析の1つとして標的抗原に対するアフィニティー(またはアビディティ)を正確に決定する必要性が明記されています。抗体の標的抗原へのアフィニティーを測定する手法に過去から現在に至るまでにさまざまな種類がある中で、Surface plasmon resonance(SPR)法は、反応速度論的(カイネティクス)解析により結合速度定数(ka値)と解離速度定数(kd値)を計測することによりアフィニティーの指標となる解離定数(KD値)等を求める分析手法として最も普及していると言えます。しかしながら、実際の、特に医薬リード候補となるような高レベルの生物活性を有するモノクローナル抗体(MAb)の抗原結合性の解析においてはさまざまな予備検討や環境設定を求められることが多いです。 最大の障壁となるのは、対象となる抗体医薬品(またはそのリードMAb)の標的抗原に対する並外れたアフィニティーの強さです。市販あるいは臨床試験段階にある一部の抗体医薬(Tanezumab、Ranibizumab、XOMA052)等では、カイネティクス解析法に限らずとも解離定数の正確な測定に苦慮することが既に報告されています [1-3]。それぞれに使用された解析機器の性能・感度や測定条件等が異なることも考慮すべきですが、いずれも標的抗原からの十分な解離現象が観察できない点で共通しています(kd値及びKD値解析が困難)。現在開発が進められている次世代抗体医薬においては、抗体抗原決定部位のin-vitro maturationによりさらにアフィニティーを人工的に上昇させる技術が応用される可能性もあり、我々にとってこの課題解決は至上命題と言えます [4]。
1. SPR法での解析手法例SPR法解析ではさまざまな機器が全世界で実用化されていますが、弊社ではCytiva社のBiacore™システムを一貫して導入してきており、使用目的や実験規模に応じて使い分けています(図1)。
本稿ではHTS解析性能に重点を置いたBiacore™ A100について詳細に解説していきます。抗体の抗原に対するカイネティクス解析では大きく分けて3種の基本的手法を採ることができます(図2)。
(1)抗原架橋法抗原分子(高分子タンパク質)を直接センサーチップ上のデキストランに架橋結合(アミンカップリング)する方法です。抗体の代表的分子であるIgGは2価の抗原結合部位を有していることから、センサーチップ上の抗原密度が高い場合には1:1結合と多価結合(2:1)が混在することになり、複数の強度の異なる結合解離現象が入り乱れ解析が困難となります。抗原そのものの架橋密度を適切に調整することによりこの問題は解決可能です。アミンカップリング法(可溶性カルボジイミド架橋)は、抗原分子上の重要な抗原結合部位を修飾する可能性があることから抗体結合性に影響を与えることが当然懸念されますが、我々の経験上むしろ問題になるのは、抗原タンパク質分子全体がストレッチされて引き延ばされる状態になり抗原の高次構造を認識するタイプのMAbの反応性が低下する点です。 (2)抗体架橋法抗体分子を精製してセンサーチップ上に架橋し、可溶性抗原との結合解離現象を解析することにより、前述のように抗原分子の立体構造変化や多価結合混在の影響は排除できます。しかしながら、問題は逆にセンサーチップ上への架橋処理による抗体そのものの活性低下が懸念されることと、抗体の再生条件の決定に苦慮するケースが意外に多いことです。抗原にせよ抗体にせよ、精製タンパク質分子をセンサーチップ上に直接架橋する手法で一番悩まされるのは再生条件の決定作業が困難であることと、そのような化学的架橋結合処理を施した段階で、そもそも元々の分子活性を何%保持しているか正確に把握できないことです。 抗体抗原反応のカイネティクス解析は、現在までこの標的抗体をセンサーチップ上にアミンカップリング等で直接架橋結合する手法が主に用いられてきており、解析上の条件設定に関する検討例も報告されていますが [5]、解析対象抗体を多数保有する状況で、効率的にそれらの候補抗体のアフィニティーを比較するという高速処理には不向きであるといえます。 (3)キャプチャー法前述の2手法の弱点を解決できる方法としてキャプチャー法が汎用されています。主流は、抗Fc領域抗体等をセンサーチップ上に架橋結合して、一定量の解析対象抗体をキャプチャーし、さらにその上に可溶性抗原を反応させ結合解離をモニターする手法です。この場合は、必ずしも解析対象抗体を事前精製する必要がないこと(例えば、抗体を含有する培養上清をそのままセンサーチップ上へ流し、前述の抗Fc領域抗体によりキャプチャーして解析対象抗体を単離する)、1サイクル毎に解析対象抗体はリフレッシュされるので頻回再生による活性低下の懸念がないこと、可溶性抗原はすべて液相状態にあるので、生理的な緩衝液中の液相状態でのnativeな立体構造を呈する抗原への解析対象抗体の1:1結合カイネティクス解析が可能となることなど、メリットが多い手法です。 唯一の難点は、解析プログラム設定にも依りますが、解析対象抗体と抗原の消費量がいずれも比較的多いことです。特に、標的抗原の消費量が比較的多い点は我々も悩まされるケースが多くあります。しかしながら、昨今の抗体医薬研究の現状では極めて希少な標的抗原を狙うケースが大半であり、通常の実験環境では抗原分子が大量に調製できないケースが多いことから、技術的に可能であれば、一過性動物細胞発現系等の遺伝子組換体として大量に可溶性抗原を発現するアプローチが推奨されます。
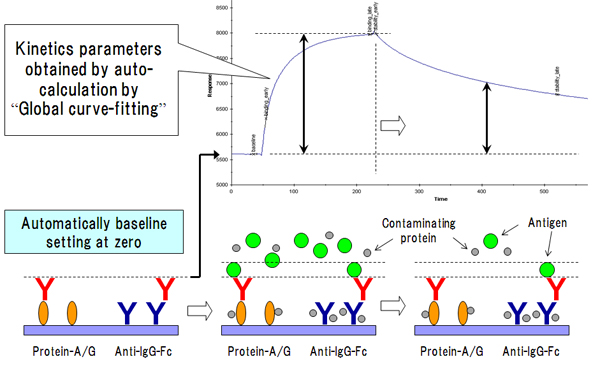
2. キャプチャー法のメリットと条件設定の必要性抗体キャプチャー法による可溶性抗原に対するカイネティクス解析を、Biacore™ A100システムを用いた場合を例にとって、その具体的なプロトコールを解説します。Biacore™ A100およびBiacore™ 4000の2機種は、現在市販されているBiacore™システムの中で唯一Hydrodynamic addressing technologyによる障壁のない同一フローセル内の液相制御が可能で、センサーチップ上の4箇所の異なるスポットに目的サンプルを流すことができるため、我々もその特徴をフルに活用しています [6]。センサーチップ(Series S Sensorchip CM5 BR100530)上には、キャプチャー用分子(anti-Fc antibody、またはProtein-A/G等)を同密度になるように並べて架橋しておき、まず最も外側のスポット(Spot-1 or Spot-5)に解析対象抗体をキャプチャーします。その時点でSPRシグナルは0点補正され、さらにその上に反応させた可溶性抗原(アナライト)の結合解離シグナルをモニターできます。可溶性抗原がセンサーチップ上のデキストランマトリックス、またはキャプチャー分子等に何らかの一過性の結合を示すケースもありますが、そのような非特異的シグナルは内側のリファレンススポット(Spot-2 or Spot-4)から忠実に差し引かれることとなり、結果として解析対象抗体の可溶性抗原への結合・解離を正確に炙り出すことが可能となります(図3)。
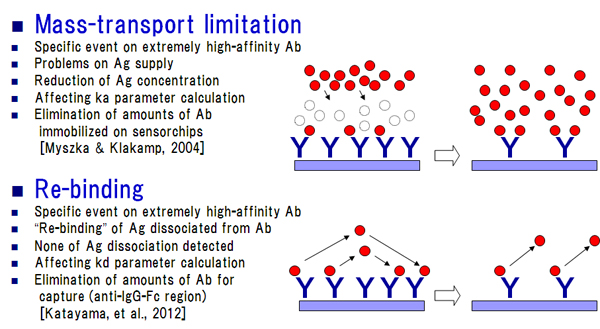
抗Fc分子を利用した抗体キャプチャー法は、前述のように抗体-抗原反応のカイネティクス解析におけるさまざまな問題を回避することが可能ですが、一部条件設定上の注意が必要となります。マストランスポートリミテーション現象とリバインディング現象と呼ばれており [7、8]、前者については既に解析対象抗体の密度を下げること等により理論的にも実験的検証からも回避可能であると報告されています[9]。しかしながら、我々の経験上からも冒頭に述べた他社の分子間相互作用解析研究の事例からも、極めて深刻なのはリバインディング現象の方です(図4)。いずれのケースもリガンドとなる解析対象抗体のアナライト可溶性抗原へのアフィニティーが極度に高いことに起因しています。我々は、キャプチャー分子の架橋密度そのものを検出限界周辺まで下げることにより、これらの妨害現象を回避できる可能性についてモデル実験により検証しました [10]。
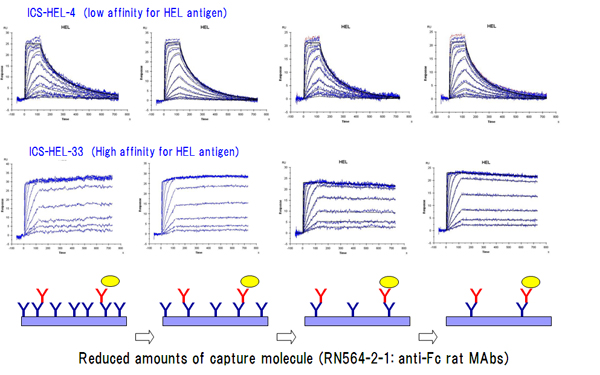
モデルケースとして卵白リゾチーム抗原(HEL)に対するアフィニティーの異なるマウスMAbを複数樹立し、別途作製したanti-マウスγ1 ラットMAb(RN564-2-1)をキャプチャー分子として利用したカイネティクス解析を行い、そのキャプチャー分子のセンサーチップ上への架橋密度を調整することにより、リバインディング現象と想定される現象を回避できた例を観察しています(図5)。
RN564-2-1(ラットMAb)は3M塩化マグネシウム溶液による数百サイクル以上の再生処理に耐性であり、通常条件のハイブリドーマ法で得られるマウスMAbの90%以上がIgG1であることを考慮すると、ほとんどのマウスMAbのカイネティクス解析が連続的に実施できるという点において大変有用です。我々は、IgG1対象解析から漏れた残りの数%にあたるマウスγ2a/b領域に対するラットMAb(RM564-18-5)も別途用意しており、そちらも安定した再生が可能であることを確認しました。このようにSPRによるキャプチャー法の実施のためには、各研究機関で目的に応じたキャプチャー分子と多サイクル解析実行が可能な再生条件の決定が必須であると言えます。
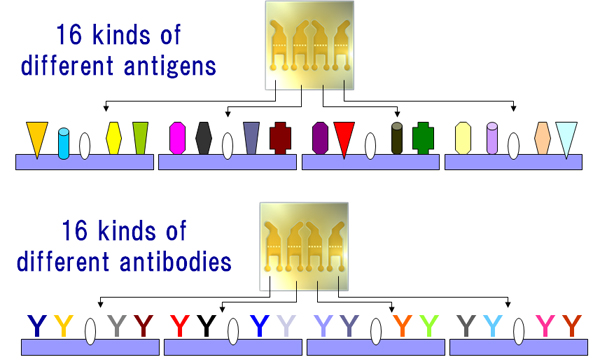
3. 抗体リード選択への応用カイネティクス解析に至るまでのリード抗体(多くは齧歯類ハイブリドーマ細胞からの培養上清由来)のスクリーニングにおいてもBiacore™ A100およびBiacore™ 4000は有用性が高いシステムです。1個のセンサーチップ上に4つのフローセルがあり、その1つのフローセル中に最大4種のリガンド(抗原、または抗体)を架橋結合させることが可能です(図6)。特に合成ペプチドをリガンド抗原として使用する場合には、一般的に再生条件にさほど神経質になる必要がなく(一般的には10 mM Gly-HCl buffer pH 1.5~で安定再生可能)数百サイクル程度の抗体スクリーニングは十分に可能です。我々は状況に応じて、予め精製した16種の異なる抗原に対するMAb等を、同時に1センサーチップ上に架橋することも実施していますが、その際に予備検討において最適の再生条件別に4群(フローセル別)に分けることが必要となります(図6)。
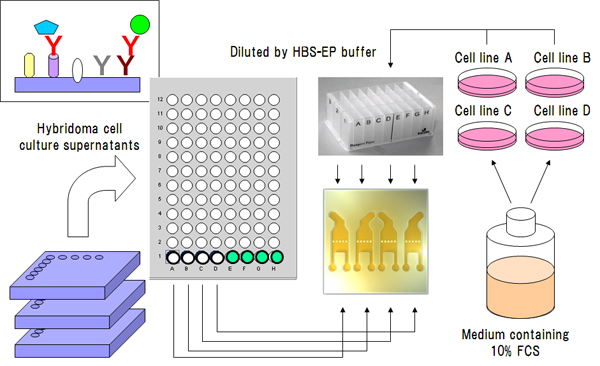
前述のキャプチャー法を利用したHTSスクリーニングも極めて有用性が高い手法です[11]。読者の方々も常時経験していることと思われますが、抗体も抗原も例えば組換体等の細胞培養上清中に分泌物として生成させることは比較的に容易ですが、往々にしてそれらを精製品として調製する場合、作業効率が悪く難易度が高いことが多いです(特に精製過程における変性・失活・凝集等に悩まされる)。キャプチャー法を効果的に利用することにより、例えばハイブリドーマ培養上清中MAbをそのままキャプチャーさせ、ついで組換体タンパク質等を発現している細胞培養上清を未精製の状態でそこに反応させ、結合シグナルをモニターすることも基本的には可能です。このようにリガンドとなる抗体もアナライトとなる抗原も精製することなくスクリーニングが実施できる点でその有用性は特筆に値します(図7)。
4. SPR法解析の標準化に関して抗体医薬原体等の性能評価項目の1つとして、自施設内でのカイネティクス解析値(KD値等)に関してどの程度の変動(測定内・測定間)が許容されるのか?ということがよく議論の対象となります。Biacore™システムでは、既に感度・操作性が異なる複数の機器が国際的に使用されており、その反応速度論的解析の標準化に関する試みがなされています。2006年に欧米を中心とする26研究機関で同一試験材料(Carbonic anhydrase IIと10種の化合物)を測定するという調査が行われ、ka値、kd値、KD値を個別に算出し、それぞれの多施設間データの変動係数が34%、24%、37%という範囲内に収まっていることが報告されています [12]。 また、タンパク質抗原(Prostate-specific antigen)とそれに対するモノクローナル抗体というより強固な結合解離(KD ≒ 1 nM)に関する反応速度解析においても欧米22研究機関で同様な標準化作業が実施され、ここでも各施設の機器内のセンサーチップ上に架橋する抗体量の最少化が綿密なプロトコール上で管理されることが施行され、各速度定数の測定誤差は14%程度に抑えられることが示されました [13]。これらのデータが3~5種類の解析感度が異なる機種間での変動であることを考慮すると、自施設同一機種内の解析値の再現性はこの数値を上回るべきであると想定されます。
おわりに抗体医薬品における抗原へのアフィニティーは最も基本にして重要な機能情報ですが、各パラメーター(ka、kd、KD値等)の正確な測定に現場の解析担当者の方々が苦慮しているのが現状です。SPR法による抗原抗体反応のカイネティクス解析には、これらの点も含めて今後もまだまだ解決しなければならない課題が多くあり、研究者間の情報共有化が最も重要であると思っています。
参考文献
「相互作用解析の王道」について「相互作用解析の王道」は、2009年8月よりバイオダイレクトメールでお届けしています。
バイオダイレクトメールは弊社WEB会員向けメールマガジンです。バイオダイレクトメールの配信をご希望の方は、下記リンク先からご登録をお願いいたします。 関連リンク津本先生の研究内容や論文などはこちら→津本浩平先生の研究室Webサイト お問合せフォーム※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。 お問い合わせありがとうございます。 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
© 2026 Cytiva