|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Location:Home > 実験手法別製品・技術情報 > BIA(生物物理学的相互作用解析) > 相互作用解析の王道 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
概論:タンパク質/バイオ医薬品の品質評価における、SPR/カロリメトリーの有用性目次
タンパク質の構造安定性タンパク質は特定の三次元構造を形成することにより、その機能を発現します。タンパク質の全体構造は、主鎖のモノマー単位であるアミノ酸の配列(一次構造)により規定されます。それらのアミノ酸が連続して規則的に形成するαへリックス、βシート構造に代表される二次構造、これらの二次構造が互いに結びつくことにより形成され、タンパク質としての機能を初めて有する三次構造、幾つかの三次構造が会合することによって形成される四次構造により特定の生物機能を発揮するようになります。そして、特に三次構造、四次構造はタンパク質と周囲の溶媒との相互作用と密接な関連があります。 ですので、タンパク質の機能が、その溶媒、温度、pHなどにより大きく影響を受けることは容易に想像できます。以上から、様々な溶媒、pHでのタンパク質の安定性を評価することは、非常に重要であることがお分かり頂けると思います。
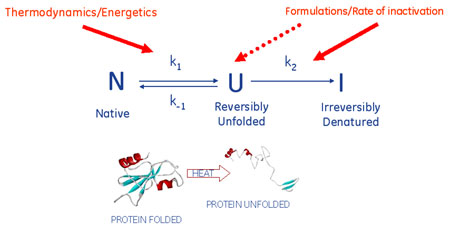
そこで用いられる代表的技術の一つが、示差走査カロリメトリー(DSC:Differential Scanning Calorimetry)です。DSCでは、温度を一定速度で上昇(下降)させた時にセル中のタンパク質が転移もしくは変性した時の熱変化を測定します。 特にバイオ医薬品の設計、製剤化においては、機能を保持した安定なタンパク質の開発、製造、および保存が大きなポイントとなります。これには、タンパク質がどのようにして活性状態が安定化されるのかを理解することが重要となります。水溶液中のタンパク質は活性を持つネイティブ構造(正しくフォールディングされた状態)と不活性な変性状態との間での平衡を保っています。ネイティブ構造のタンパク質の構造安定性は熱力学第二法則(ΔG = ΔH -TΔS)で記述されます(図1)。
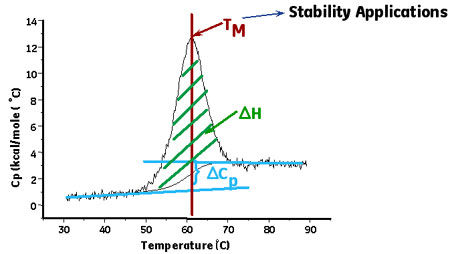
系のギブズ自由エネルギー変化ΔGが負の値であるということは、ネイティブ構造のタンパク質構造が変性状態より安定であるということを示しています。ΔG がより小さな値(絶対値がより大きな値)をとればネイティブ構造の安定性が増したことを意味します。タンパク質を変性させるにはこの安定化に寄与している力を壊す必要があります。たとえばタンパク質溶液を高温にさらすことによって立体構造の自由度が増大し、熱変性が引きおこされます。タンパク質の熱変性によるアンフォールディングのΔHはDSCを用いて直接的に測定することができます。タンパク質の熱変性プロセスにおけるDSCカーブは、変性中点(Tm)と呼ばれる温度を挟んだ吸熱ピークとなり、そのピークを積分することによってΔHが得られます。一般的にTmは熱安定性の一つの指標であり、Tmが高いタンパク質分子は生理活性化条件においてより安定であると考えられています。また、タンパク質が熱変性をおこす際の熱容量変化(ΔCp)も測定することができます。熱変性に付随しておこる熱容量変化は、主にタンパク質内部のアミノ酸側鎖が変性にともなって溶媒分子に露出して水和することに起因するとされています。 (図2)
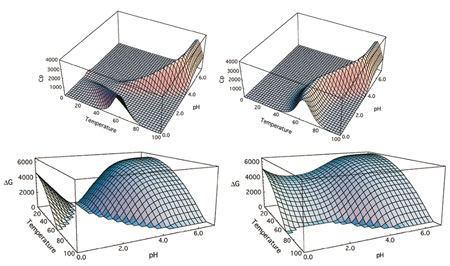
タンパク質の安定性には、疎水性相互作用、水素結合、構造エントロピー、pH、イオン強度、および温度等の物理的環境に大きく関与します。ΔH、ΔCp、Tmなどのパラメータを用いてこれらの要因を出来るだけ定量的に記述し、かつそれをタンパク質医薬品の開発や品質評価の指標として応用することで、バイオ医薬品の信頼性をより高める試みがなされています(図3)。
実際は、昇温速度を変化させることによってこれらのパラメータがどう変化するか、あるいは複数検出されるピークのどれがどういう構造変化に起因するか、などが重要な課題となってきますが、これは次回以降にお話しします。経験的ではありますが、会合凝集形成のしやすさなども予測可能な測定法といってよいかもしれません。 「相互作用解析の王道」について「相互作用解析の王道」は、2009年8月よりバイオダイレクトメールでお届けしています。
バイオダイレクトメールは弊社WEB会員向けメールマガジンです。バイオダイレクトメールの配信をご希望の方は、下記リンク先からご登録をお願いいたします。 関連リンク津本先生の研究内容や論文などはこちら→津本浩平先生の研究室Webサイト お問合せフォーム※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。 お問い合わせありがとうございます。 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
© 2026 Cytiva