|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Location:Home > 実験手法別製品・技術情報 > BIA(生物物理学的相互作用解析) > 相互作用解析の王道 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
実践編-4:フラグメントライブラリーの測定におけるSPR/ITC戦略の実効性と効率的活用法(1)目次
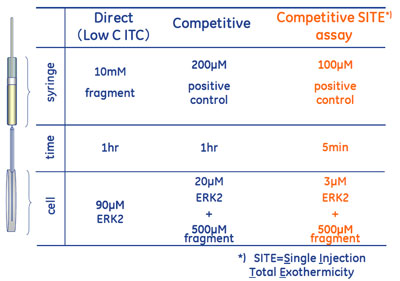
選出されたフラグメントのITCを用いた効率の良いヒットバリデーション法とエンタルピーランキング法(competitive SITE法)FBDDの分析手法としては、X線構造解析、NMR、そして先にあげたSPRがすでによく使われている手法と言って良いと思います。ITCは、得られるデータが魅力的である反面、必要サンプル量が多いことやスループットが比較的低いことも知られており、FBDD分析手法に組み込むことへはまだ二の足を踏んでいる研究者の方も多いかと思います。 ここでは、何故FBDDにおいてITCのデータが魅力的なのかということと、どうにかしてサンプル量やスループットの問題を軽減できないかということをお話ししたいと思います。 医薬品化合物を設計していくには、高アフィニティーの化合物(KDが小さい、ΔGが負に大きい)を目指して最適化していくことが一般的にされていることですが、そのためのルートとしては(式1)が示すようにエンタルピー変化を負(発熱)に大きくするか、エントロピー変化を正に大きくするかの2通りあるということが言えます。 ΔG = ΔH - TΔS(式1) ※ ΔG:自由エネルギー変化、ΔH:エンタルピー変化、ΔS:エントロピー変化 非常に大まかにいうと、ΔHが負に大きい相互作用は水素結合やファンデルワールス力が大きく寄与しており、結合選択性を期待できる性質をもちます。一方ΔSが正に大きい相互作用は疎水結合が大きく寄与している可能性があります。また、一般的に標的タンパク質との間に水素結合がきちんと起こるように合成デザインすることは難しく、合成展開が進み分子量が大きくなるにしたがって疎水性が増大します。そこでフラグメントスクリーニングにおいては、まずエンタルピー変化が負に大きい(発熱の大きい)フラグメントをまず選出して、その後の合成展開ではエントロピー変化を正に増やす(疎水結合)ことでアフィニティーを高める戦略を取った方が成功しやすいとされています。すなわち、FBDDにおいてITCによってもたらされるサーモダイナミクス情報は非常に大きな武器になり得るのです。 表2のとおり、フラグメントのような弱い相互作用をダイレクトに測定した場合 (Low C ITC法)、相当量のサンプル量と時間が必要になります。またITCのデザイン上、シリンジ側の化合物は10 mMという高濃度が必要になりました。これはいくら水溶性が高いフラグメント化合物でも溶解しないものが相当数出てくる濃度といえます。そこで、アフィニティーの比較的強いポジティブ・コントロールの化合物をシリンジに、タンパク質と過剰量のフラグメント化合物の混合溶液をセル側に入れ、競合アッセイで測定したところ、タンパク質やフラグメントの濃度を下げることができました。さらに、この競合アッセイを10-20回滴定で行っていたところを1回滴定にすることにより、より低濃度で測定時間を減少させることができました。この方法では、ΔG(KD)やΔH、ΔSのような値を定数化することはできませんが、フラグメントの結合に伴う発熱量を間接的に観察することができます。このことを利用して、SPRのスクリーニングで起こるNSBに起因した偽陽性を振るい落とすことも簡単にできます。なぜなら一般的にNSBは熱収支をほとんど伴わないからです。さらに、各フラグメントの相互作用に伴う発熱量をランキングし、よりエンタルピーが寄与している相互作用を有するフラグメントを迅速に選出することが可能になりました。この方法をCompetitive SITEと名付け、実際に適用した実験例を次回ご紹介したいと思います。
「相互作用解析の王道」について「相互作用解析の王道」は、2009年8月よりバイオダイレクトメールでお届けしています。
バイオダイレクトメールは弊社WEB会員向けメールマガジンです。バイオダイレクトメールの配信をご希望の方は、下記リンク先からご登録をお願いいたします。 関連リンク津本先生の研究内容や論文などはこちら→津本浩平先生の研究室Webサイト お問合せフォーム※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。 お問い合わせありがとうございます。 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
© 2026 Cytiva