エピトープマッピングとは、抗体が抗原のどの部分を認識するかを調べる実験手法です。抗原を断片化したペプチドを合成し、Biacore™により抗体との相互作用を測定することで反応部位を調べることができます。
また、Biacore™の検出原理であるSPR技術を用いると、分子間相互作用をノンラベルでモニターすることができるため、抗原に対して複数の抗体が結合する多段階反応を、リアルタイムでモニターすることが可能です。
こちらの論文では、HIV-1コアタンパク質p24に対する複数のハイブリドーマを作成して、その培養上清を用いて、エピトープ特異性を評価しました。はじめにtwo-site binding assay(エピトープビニング)により抗体のペアで、結合の干渉がどの程度生じるか測定しました(図1、2)。
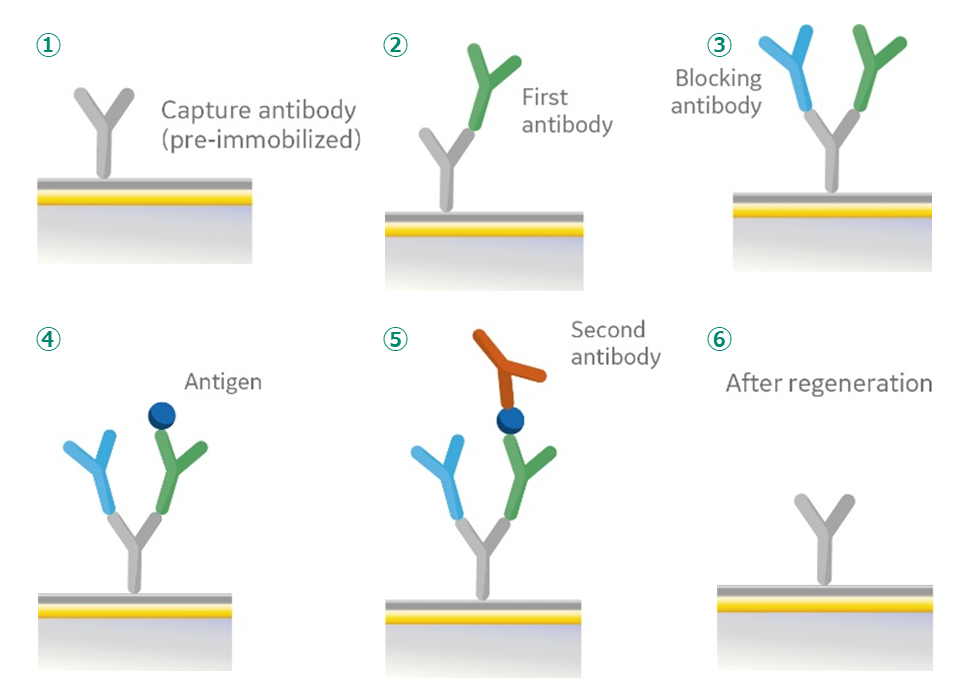
図1.Two-site binding assay(エピトープビニング)の詳細
- ポリクローナルウサギ抗マウスIgG1(RAMG1)の固定化
- 1st MoAbを含む未希釈ハイブリドーマ上清の添加
- フリーのRAMG1をブロッキングするnon-specific MoAb (50 pg/mL of anti-AFP antibody in HBS omitting NaCI) の添加
- 10 pg/mL p24抗原in HBSの添加
- 2nd MoAbを含む未希釈ハイブリドーマ上清の添加
- 100 mM HCl による再生
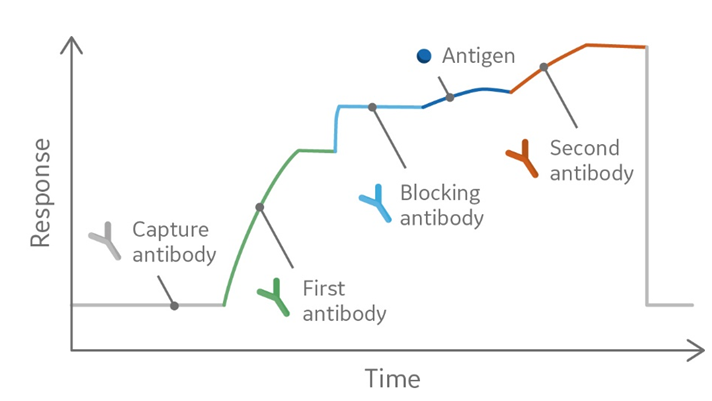
図2.キャプチャー法のtwo-site binding assay(エピトープビニング)より得られるセンサーグラム
続いて、同様の手法で、2nd抗体の後に再生を行わずに連続8つの抗体をインジェクションすることで、多段階の複合体形成をモニターできることが示されました(図3)。
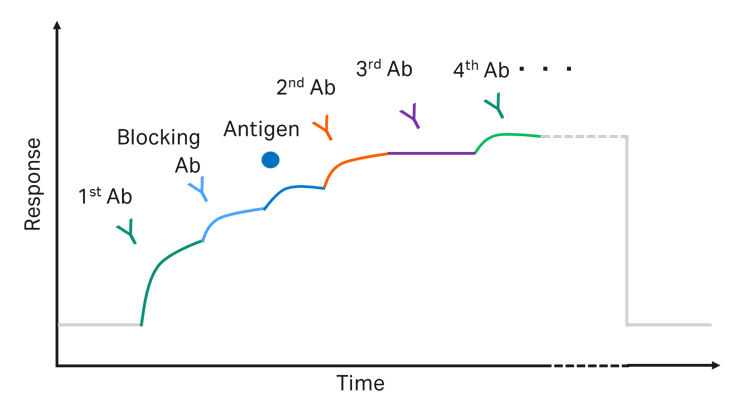
図3.キャプチャー法のmulti-site binding assayより得られるセンサーグラム
さらに、p24タンパク質の一次構造から7種類のペプチドを合成し、センサーチップに直接固定化したp24抗原に対して、各種のハイブリドーマとペプチドを混合したアナライト溶液を流しました。こちらの阻害実験により、抗体が抗原のどの部分を認識するか、より詳細な特性解析が実施されました。
標識などを用いる分子間相互作用測定の手法では、エピトープビニング/マッピングの実験はとても煩雑で、初期のスクリーニングに組み込まれることはありませんでした。Biacore™を用いることにより大規模な測定が実現可能となります。また、こちらの論文はBiacore™社時代のアプリケーションノート第一号にもなりました。