はじめに
Biacore™には、まだまだお伝えできていない機能があるかもしれません。これを知っていると実験の幅が広がるかもしれない。そんな隠れた機能を取り上げていきます。今回のお題は、「Dual injection」と「A-B-A injection」です。
Biacore™では、リガンド、アナライト、再生溶液などをインジェクションする際、通常、その間には必ずRunning bufferが流れその時点でのレスポンスをレポートすることになっています。
しかし、測定内容によっては、間にRunning Bufferを挟まずに2液を連続で流したいというケースがあります。そんな時にご使用いただけるのが、Dual injection と A-B-A injectionです。それぞれの違いを確認しましょう。最後に対応機種の一覧を示しています(表1)。
Dual injection
Dual Inject は、1 つ目のサンプル添加終了後、ランニング緩衝液での自動洗浄をはさむことなく、引き続き 2 つ目のサンプルを添加することができます。ただし、図1の通り、Biacore™ T200/S200 Control software では、General コマンドとして実行できるインジェクションであり、一部を除きフィッティング解析はできません(表1)。通常、2液を連続添加した時のレポートポイント(RU)を用いた比較解析を行います。
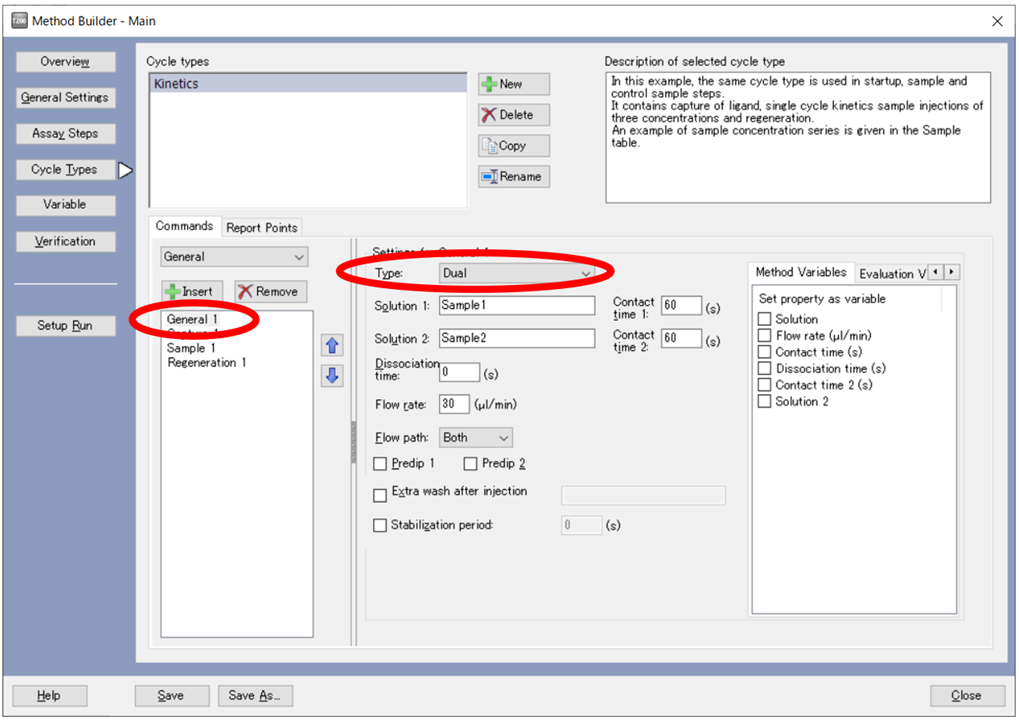
図1:Biacore™ T200 Control Software - Method Builder – Type: Dual
測定の一例として、抗体のエピトープビニングがあります。エピトープビニングとは、抗体開発において、選抜された抗体が、抗原の同じエピトープに結合するかを測定する技術です。Sandwich法と呼ばれる手法の場合、一次抗体をセンサーチップに固定化し、抗原に続いて二次抗体をインジェクションすることで、二次抗体のレスポンスの有無から、同じビンである(同じエピトープを認識する抗体である)かどうかを評価します。
図2は(A)Dual injectionなし、(B)Dual injectionありでSandwich法によるエピトープビニング測定を行ったセンサーグラムです。
Dual injectionなしで、抗原と二次抗体のインジェクションの間にBufferが流れてしまうと、一次抗体と抗原が低親和力の場合に二次抗体の結合量を見積もれないことがあります。このような場合、Dual injectionを用いることで一律のThresholdで二次抗体のレスポンスを評価することが可能となります。
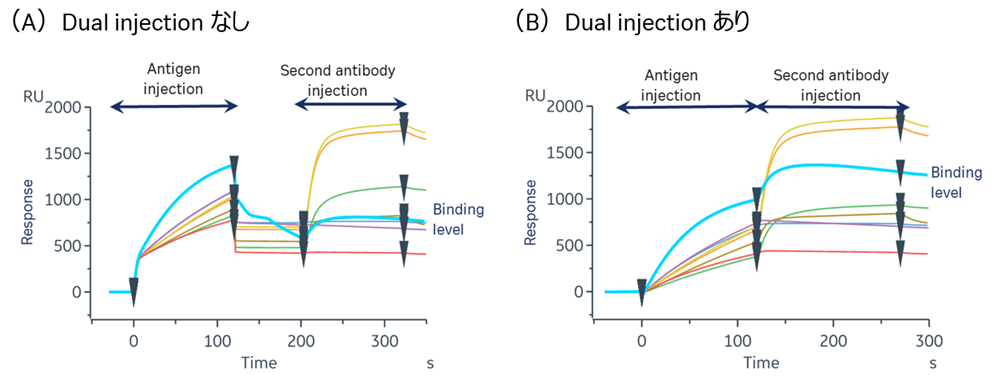
図2:エピトープビニングにおけるDual injectionの活用方法
エピトープビニングの詳細に関しましては、Cytiva Webinar「抗体スクリーニングにおけるEpitope binningの活用とBiacore™での測定」をご覧ください。
図3は、子宮内膜・卵巣がんのバイオマーカーであるRAGE(Receptor for Advanced Glycation End Products)とADCs(Antibody-Drug Conjugates)の相互作用を評価した事例です。
エンドソーム内における解離を評価するため、細胞外(pH 7.4)、エンドソーム内(pH 6.0)の環境を模倣した二種類のpHで解離の違いを測定したものです。
Biacore™ T200でDual injectionを用いて、ADCsをキャプチャさせたセンサーチップに対して、RAGEを添加した後、続けて、pHの異なるbufferを添加しました。結果、解離180秒目において、pH 7.4では25%解離するのに対して、pH 6.0では45%の解離が確認できました。
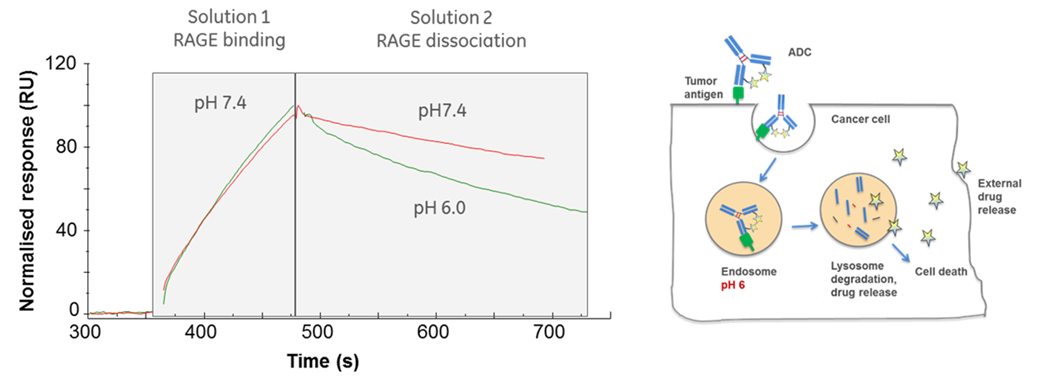
図3:ADCs評価におけるDual injectionの活用方法
左図の縦軸は、RAGE溶液添加終了時のレスポンスを100としたNormalized response (RU)です。
詳細は以下でご覧いただけます。
同様に、以下のアプリケーション資料では、抗体とFcRnの相互作用におけるpHの影響に関してDual injectionを用いた比較を行っています。
- Biacore™ concentration and ligand-binding analyses in late-stage development and quality control of biotherapeutics
FcRn の相互作用として、低 pH(約 6.0)および高 pH(約 7.4)で測定しています。これは FcRn がリソソームによる分解から抗体を保護する条件(低 pH)および抗体が細胞表面から放出される条件(高 pH)を模倣しています(アプリケーションノートFig 8.)。
A-B-A injection
A-B-A Injection は、Solution A添加終了後、ランニング緩衝液での自動洗浄をはさむことなく、引き続きSolution Bを添加し、再びSolution Bを添加ことができます。Biacore™ 8K Control Softwareでは、Buffer Scouting using A-B-AというMethodがプリセットされています(図4)。 また、他のMetohdを編集して 、アナライト添加のコマンドをA-B-A に変更することも可能です。A-B-A Injection は、フィッティングによるデータ解析が可能です。
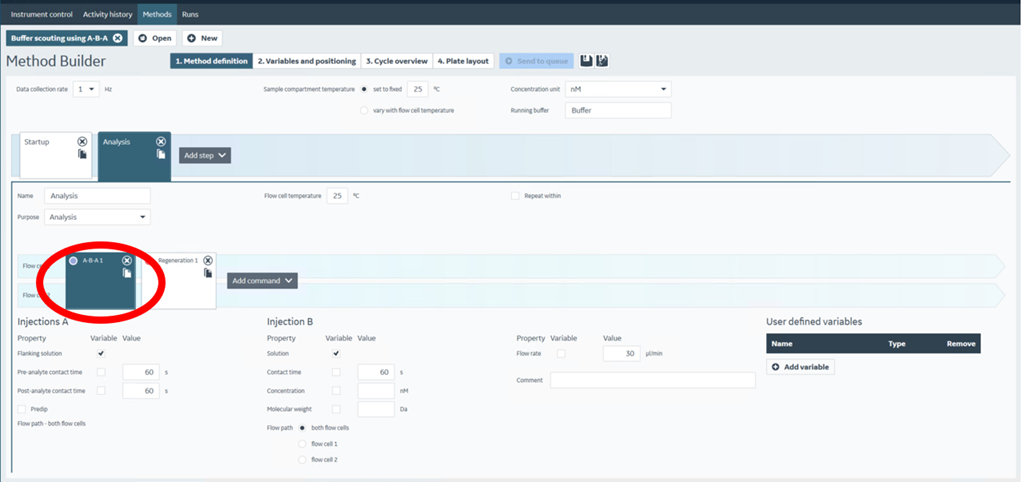
図4:Biacore™ 8K Control Software – Buffer Scouting using A-B-A
通常、Solution Bは、Solution Aをベースに調整した溶液とし、図5のようなセンサーグラムが得られます。用途として、以下のようなものが挙げられます。
- 何十種類ものRunning buffer検討を迅速に行いたい。
Solution A:候補となるRunning buffer
Solution B:Solution Aで調整したアナライトサンプル - アロステリック結合の評価。例:ATP存在下で生じる相互作の測定。
Solution A:ATPを含むRunning buffer
Solution B:Solution Aで調整したアナライトサンプル - 結合サイト特異的化合物との競合阻害試験。
Solution A:競合阻害分子を含むRunning buffer
Solution B:Solution Aで調整したアナライトサンプル
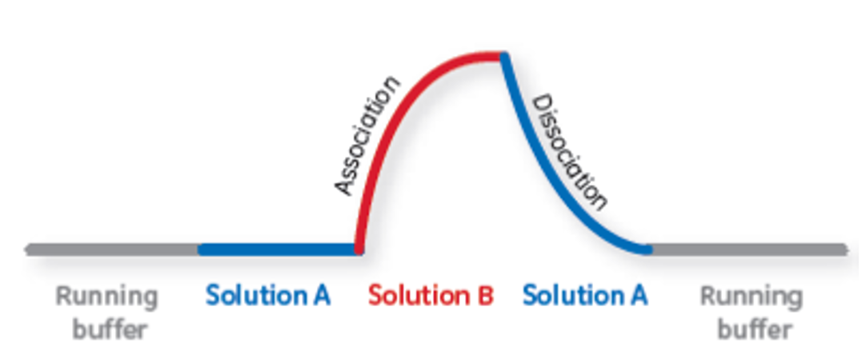
図5:A-B-A injectionによるセンサーグラムイメージ
図6は、溶液中の塩濃度の違いによるモノクローナル抗体の親和性の評価を行った事例です。50mMから600mMへと塩濃度を上げると、4種類の抗体のうち3種類が2~5.5倍程度KD値が減少しました。mAb12のみ塩濃度の影響をほとんど受けませんでした。このように、A-B-A injectionを用いることで、多条件のRunning buffer検討を迅速に行うことができます。
診断薬用の抗体開発においては、生理的条件下での相互作用が必要とされません。そのため、より明瞭な診断が可能な、親和性の高いbuffer条件が求められることがあります。
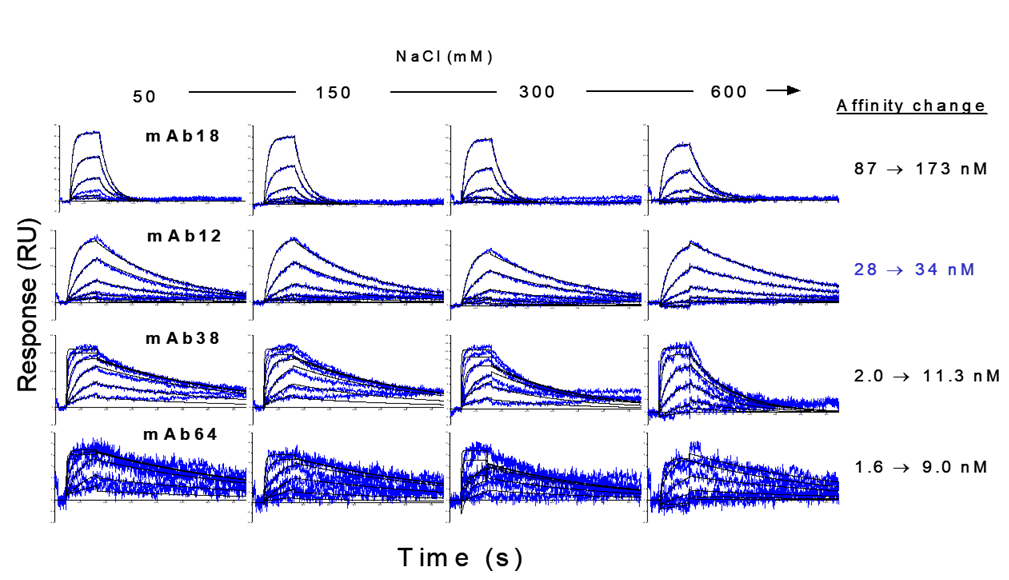
図6:塩濃度の違いによるモノクローナル抗体親和性への影響。
また、以下のアプリケーション資料は、低分子化合物とITK (interleukin-2-inducible T-cell kinase)の相互作用における競合阻害試験の例が記載されています。
- Increased SPR-sensitivity enables fragment screening and kinetic characterization at lower surface densities
本化合物は、ATP存在下でITKの2つのサイトに対してヘテロに結合します。競合阻害剤によりATP結合サイトをブロックすることで、1:1結合の様式に変化することが確認できました(アプリケーションノート:Characterization of dual-site binders)。
注意:A-B-A injectionにおけるSolvent Correction(溶媒補正)
DMSOに溶解された低分子化合物を測定する場合、通常、Solvent Correctionを実施します。A-B-A injectionにおける注意点として、Defaultの設定ではSolution AとSolution BにおけるDMSO濃度の違いを補正します。これは、BaselineがSolution A添加開始前となっているためです(図7A)。
しかし、実際にはRunning bufferとSolution Bにおける補正を行う必要がありますので、Baseline report pointをSolution Bの注入開始前からSolution Aの注入開始前に変更する必要があります(図7B)。
例えばA液(図7のinhibitor)を60秒間添加している場合、ベースラインのレポートポイントをB液添加前の70秒辺りにずらす必要があります。Biacore™ S200では、Control Softwareでデータを開いた後、各Sampleのセンサーグラムについて、メインメニューのEdit > Report point > Edit...から変更します。Biacore™ Insight Evaluation Softwareでは、データを開いた後、HomeのReport pointsから、A-B-A baselineのTime (s)を変更します。
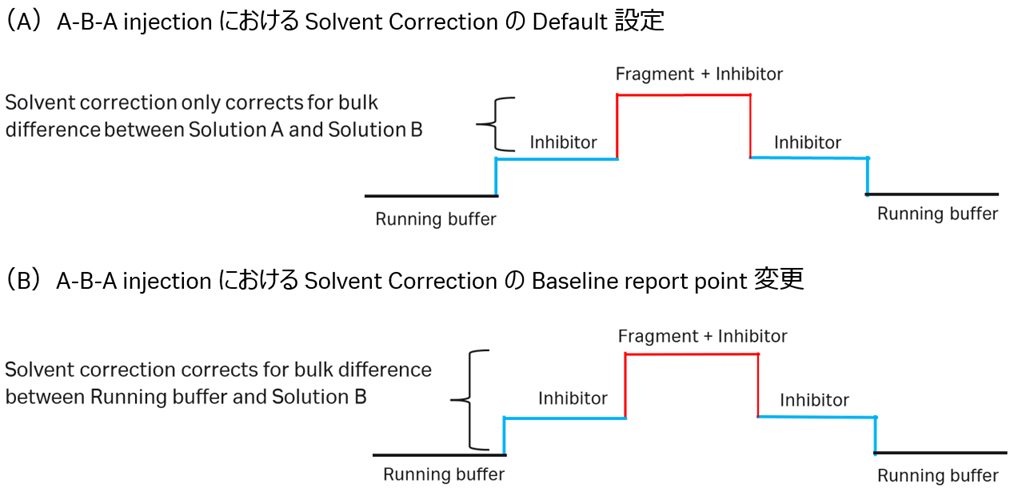
図7:A-B-A injectionにおけるSolvent Correctionの注意点
Dual injection および A-B-A injectionに対応した機種を表1に示しました。サンプル溶液の連続Injectionが必要な場合、これらの機能をお試しください。
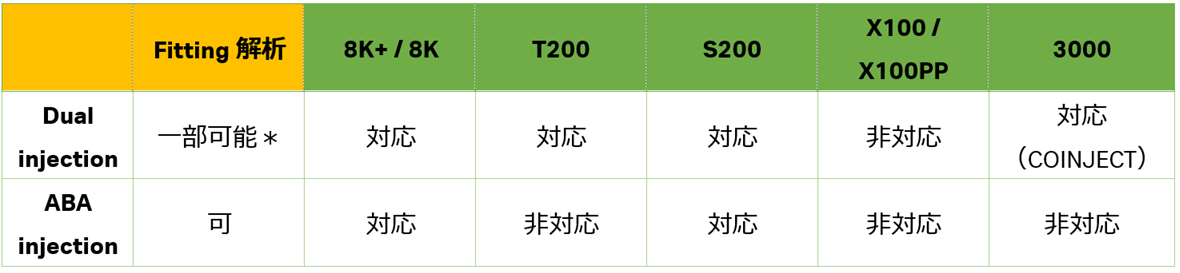
表1:Dual injection / A-B-A injection の対応機種
*:Insight Evaluation Softwareでは、Dual injectionに対してFitting解析は実行可能です。特に解離速度のみを評価する1:1 Dissociationモデル式を使用する場合に有効です。