|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Location:Home > 実験手法別製品・技術情報 > BIA(生物物理学的相互作用解析) > 相互作用解析の王道 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
原理:其は王道を歩む基礎体力(7)目次 3. 等温滴定型熱量測定3-1. 測定原理
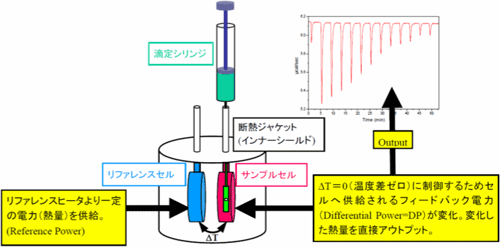
等温滴定型熱量測定 (Isothermal Titration Calorimetry;ITC) は結合成分を標的分子に滴下した際に起こる化学反応もしくは結合反応を観測する熱力学的方法です。物質同士が結合するときには熱の発生もしくは吸収が起こるため、この熱量を測定することにより相互作用の結合定数(kass)、反応の結合比(n)、エンタルピー変化(ΔH)、およびエントロピー変化(ΔS)を精度良く得ることができます。他の手法と異なり、試料への化学修飾や物理的固定化等を必要とせず、自然状態に近い環境下で測定できます。また、1回の実験で分子間相互作用の完全な熱力学的プロファイルを把握できることも特長の一つといえます。 ITCの装置内部にはサンプルセルとリファレンスセルが備わっており、任意の一定温度に保たれたサンプルセル中の標的分子溶液に対して、滴定シリンジ中のリガンド溶液を数マイクロリットルずつ逐次滴定します。リガンドがサンプルセル内へ滴定されて両物質が相互作用すると、結合量に正比例した熱の発生または吸収が起こります。リガンド滴定の進行に沿ってサンプルセル中の標的分子の結合サイトが飽和され、熱シグナルは減少して最終的にリガンドの希釈熱のみが観測されるようになります。Fig. 4にその模式図を示しました。
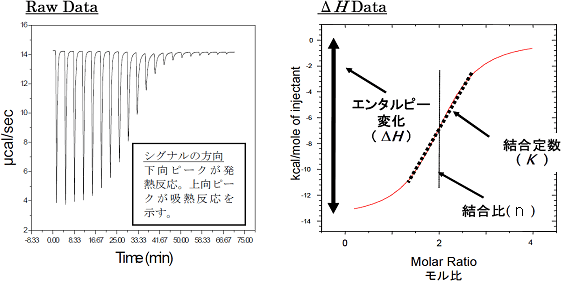
Fig. 5に典型的なITCデータと等温滴定曲線を示します。左図はリガンド溶液をサンプルセル中の標的分子溶液へ合計18回にわたって滴下したときのデータを示しており、各滴定ピークの面積はその滴定によって発生した熱量に等しくなります。また、各滴定の発生熱量をセル中におけるリガンドと標的分子のモル比に対してプロットすることにより右図のような相互作用の結合等温線が得られます。この例の場合、カーブフィッティングにはOne-Set-of-Sitesモデルを使用し、得られたベストフィットカーブを赤線で示してあります。各フィッティングパラメータから、結合定数、結合比、エンタルピー変化を求めることができます。
滴定のデータから結合定数Kを以下のように求めることができます。 化学量論的に1:1の反応に対して、M+X=MXの結合平衡は次式で記述されます。
ここでKは結合定数です。 MX濃度の変化は、熱変化として次式と関連付けられます。
ここでΔHoは結合のモルエンタルピー、Voはセル容積、Qは吸収または発生した熱量です。 (f16)、(f17)、(f18)、(f19)式より次式が導かれます。
ここで、r=1/(K Mtot)、Xr=Xtot/Mtotです。 滴定型熱量測定装置で測定される実験的パラメータは示差熱dQ/dXtot(実際にはΔQ/Xtot)です。ΔHoは滴定曲線下の総面積から得られます。上記のようにして、測定値としてΔHoとKが求められるので、(f21)式よりギブスエネルギーΔGoとエントロピーΔSoが算出されることになります。
「相互作用解析の王道」について「相互作用解析の王道」は、2009年8月よりバイオダイレクトメールでお届けしています。
バイオダイレクトメールは弊社WEB会員向けメールマガジンです。バイオダイレクトメールの配信をご希望の方は、下記リンク先からご登録をお願いいたします。 関連リンク津本先生の研究内容や論文などはこちら→津本浩平先生の研究室Webサイト お問合せフォーム※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。 お問い合わせありがとうございます。 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
© 2026 Cytiva