|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Location:Home > 実験手法別製品・技術情報 > BIA(生物物理学的相互作用解析) > 相互作用解析の王道 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
実践編-1:抗シガトキシン抗体の相互作用解析例(5)目次
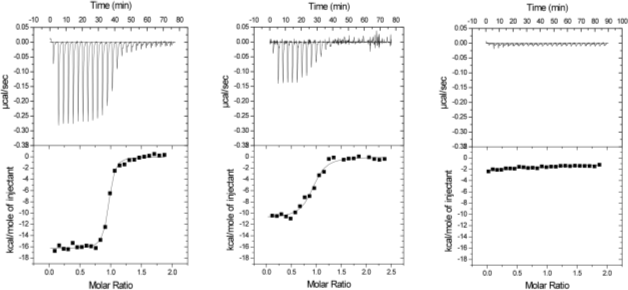
4. 実験結果4-2. 抗原抗体相互作用の熱力学的解析次に、10C9 Fabの抗原認識に伴う熱力学的パラメーターを算出するため、等温滴定型熱量測定(ITC)による解析を行いました(Fig. 6)。溶媒にはPBSを用い、25℃条件下で測定しました。抗体は測定溶媒と同じ組成のPBSにて透析後、50 µMに濃縮した溶液をシリンジに充填し、10 µLずつセルに滴下しました。セル側には、5 µMの抗原3種類(CTX3C-ABC、CTX3C-ABCD、CTX3C-ABCDE)をそれぞれ充填しました。抗原はストック溶液として5-10 mM DMSO溶液の状態で-20℃条件下で保存し、測定の際に測定溶媒と同じ組成のPBSにて希釈することで濃度調整を行いました。
もっとも全長が短い抗原CTX3C-ABCでは、明らかな反応熱は確認できませんでした。それに対し、抗原CTX3C-ABCD、ABCDEでは、いずれも抗原抗体反応に特徴的なエンタルピー駆動型の反応を示し、1:1の量比で結合することが確認できました(Table 1)。
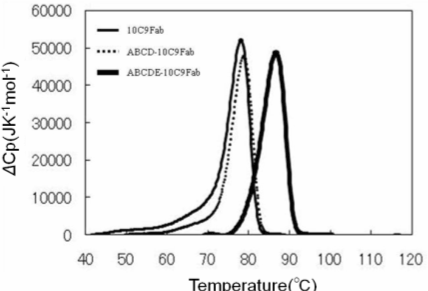
エンタルピーの値は、CTX3C-ABCD、ABCDEがそれぞれ-45.7、-68.4 kJmole-1であり、CTX3C-ABCDE認識ではエンタルピー得の寄与が特に大きいことが示されました。X線結晶構造解析によって明らかとなった抗原抗体相互作用の差を考慮すると、およそ20 kJmol-1もの顕著なエンタルピー差は、単に抗原結合部位に留まらず10C9Fab抗体分子全体に及ぶ安定化エネルギーに相当な差が生じていると推察されます。また、エントロピーの値は、CTX3C-ABCD、ABCDEでそれぞれ-15、-76 Jmol-1K-1でした。両者の間で水和水の数に差がないことから、CTX3C-ABCDの方がある程度分子の自由度が高い状態であることを示しています。結合定数Kの値は、CTX3C-ABCD、ABCDEがそれぞれ1.5×107、9.0×107 M-1であり親和性には6倍程度の差が見られ、CXT3C-ABCDEは10C9Fabとエンタルピー的により有利に結合することが明らかとなりました。 さて、ここでこれらの値が持つ意味を考えてみましょう。まず、この相互作用は発熱反応、すなわちエンタルピー変化量がマイナスの値でした。どんな生体分子相互作用も基本的には水溶液中で起こります。当然相互作用部位もリガンドも水和していることになります。相互作用において、相互作用部位の水和水は除去される、すなわち脱水和されることになります。これがいわゆる疎水的相互作用、と呼ばれる相互作用です。化学の教科書を見ると、この脱水和は通常吸熱反応のはずです。すなわち、水和している水分子を除去するためには、水素結合を切断しなくてはなりませんから、熱を吸収することが必要となり、これは吸熱反応として現れ、エンタルピー変化量はプラスの値を示すはずです。今回の相互作用も、抗原結合部位に疎水的なアミノ酸は多いですし、抗原も環状ポリエーテル化合物ですので疎水性が高いため、この分子の周辺にある水和水の除去で吸熱となってもおかしくありません。ですが、実際には発熱反応となりました。では、発熱反応となるような非共有結合とは何でしょうか。これはズバリ、ファンデルワールス相互作用や水素結合、塩結合(塩橋)、これらすべてが発熱反応となります。ですので、今回の相互作用は、疎水的相互作用、と説明されながらも、実際は、形成される非共有結合から発生する熱量がはるかに大きく、結果として、相互作用は発熱、すなわちエンタルピーの変化量はマイナスの値となるわけです。 では、今回の相互作用でCTX3C-ABCDEとCTX3C-ABCDの相互作用における20 kJmol-1もの値の差は何に起因するのでしょうか。この値の相違を、特定の非共有結合の差に起因している、と議論したくなるものですが、結晶構造解析からも分かりますように、今回の相互作用では、E環のあるなしの相互作用の差だけでは説明できません。もう一つ、Fig. 5に示しましたような、構造変化の相違も原因として考えられます。E環のあるなしでリガンドの水和状態も相違があるかもしれません。なので、実際は20 kJmol-1の差が生じる、ということしかないのです。言い換えれば、エンタルピー変化量を過大評価していろいろな可能性を議論することは極めて危険である、ということになります。加えて、相互作用におけるエンタルピー変化量を予測することは、たとえ官能基を一つ導入したり除去したりということをしたときでさえも、極めて困難であるということも指摘しておかなくてはなりません。このことは次回フラグメントスクリーニングのところでもう一度お話しします。 エントロピー変化量はどうでしょうか。先程述べましたような疎水的相互作用は水和水の自由度を高めるという意味でかならずエントロピー変化を有利にさせる(増大させる)、ということになります。一方、相互作用によって非共有結合が形成されれば、その部位は自由度が減少しますので、エントロピー変化を不利にさせる(減少させる)ことになります。今回の相互作用でいえば、CTX3C-ABCD、ABCDEでそれぞれ-15、-76 J mol-1 K-1となりました。この差は、リガンドの水和構造の違いに起因しているという可能性はあるものの、結晶構造解析から明らかになったように、両者の間で水和水の数に差がないことから、CTX3C-ABCDの方がある程度分子の自由度が高い状態であることと強い相関がありそうです。分子全体の自由度に関しての予測は難しいのが現状ですが、官能基の導入、除去のレベルでのエントロピー変化は予測が可能である、というのが私たちの最近の印象です。これについても次回以降お話しします。 次に、抗原結合の有無による抗体の熱安定性の差を明確に示すため、示差走査型熱量測定(DSC)を行いました。溶媒にはPBSを用い、10℃~120℃の範囲で1℃/分で昇温させ、そのときの各10C9Fab抗体の変性温度(Tm値)を算出しました。Tm値は、それぞれの比熱容量の極大値を与える温度としました。また、抗原抗体複合体溶液は、いずれも抗体のモル濃度に対して1.2倍の終濃度となるようCTX3C-ABCDEを添加しました。Fig. 7には、10C9Fab単独、10C9Fab・CTX3C-ABCD複合体、ABCDE複合体の測定結果を示します。
抗体単独での変性温度(Tm値)は78℃付近であり、一般的なFabのTm値が75-80℃であることを考慮すると、10C9Fabは平均的な熱安定性を有していることが分かります。しかし、非常に興味深いことに、10C9Fabは複合体を形成すると、CTX3C-ABCDではおよそ0.8℃、CTX3C-ABCDEではおよそ10℃もの熱安定化が得られることが明らかとなりました。このことは、10C9 Fab・CTX3C-ABCDE複合体では構造が極めて安定化されていることを意味しています。一方、10C9Fab・CTX3C-ABCD複合体は10C9Fab単独とほぼ同程度の熱安定性を有していることになります。ここで、結晶構造解析の結果を思い出してみましょう。10C9Fab・CTX3C-ABCD複合体では、CDRループの構造は安定化されていたのですが、定常領域の構造は逆に不安定化することが明らかとなっていました。これは、CTX3C-ABCDの結合によって熱安定化が得られなかったことと対応するように見えます。 以上の測定結果は、結晶構造解析およびITC測定結果ともよく一致しています。すなわち、10C9Fab・CTX3C-ABCDE複合体では非常に効率よく分子全体の立体構造が安定化される一方で、10C9Fab・CTX3C-ABCD複合体では抗原のE環の欠損によって可変領域、定常領域に構造変化を引き起こすため、十分な安定化が獲得できないという抗原の長さによる認識能の違いが明らかになりました。 「相互作用解析の王道」について「相互作用解析の王道」は、2009年8月よりバイオダイレクトメールでお届けしています。
バイオダイレクトメールは弊社WEB会員向けメールマガジンです。バイオダイレクトメールの配信をご希望の方は、下記リンク先からご登録をお願いいたします。 関連リンク津本先生の研究内容や論文などはこちら→津本浩平先生の研究室Webサイト お問合せフォーム※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。 お問い合わせありがとうございます。 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
© 2026 Cytiva