はじめに
膜タンパク質を標的分子としてBiacore™で測定する際の考え方や方法論についてまとめました。過去の測定例から最新の測定例までご紹介いたします。みなさま方のサンプルに合わせて最適な方法を選択し、測定していただければと思います。
ご承知の通り、細胞膜はリン脂質の二重膜で、膜タンパク質はこの二重膜に付着、もしくは埋め込まれています。全タンパク質の約25% が膜タンパク質であり、全膜タンパク質の50% は1回膜貫通型膜タンパク質であり、2番目に多いのは7回膜貫通型膜タンパク質です。
7回膜貫通タンパク質はしばしば受容体です。輸送タンパク質はより複雑で、最大14回膜を貫通することが多いようです。Biacore™における膜タンパク質の測定は、以下に示す理由から、チャレンジングと言えます。
- 活性を維持することが困難
- 用意できるサンプル量が少ない
- 結合様式が複雑になりがち(1:1 bindingのようなシンプルなものになりづらい)
- 非特異的結合が見られがち
代表的な膜タンパク質の4つの測定方法
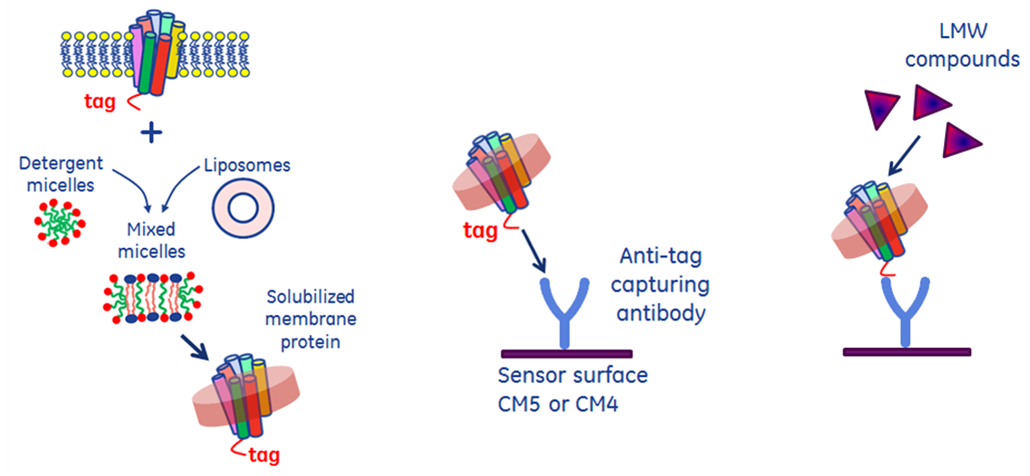
Biacore™のセンサーチップ上で膜タンパク質を測定する方法は4つに大別されます。いずれの方法でも、膜タンパク質の安定性と活性の維持が重要です。以降ではこちらの下3つの例を紹介していきます。
- 膜タンパク質の可溶化ドメインや変異体を使用
- 界面活性剤で可溶化
- 細胞膜様の環境下で可溶化
- 細胞膜中の膜タンパク質を使用(細胞を固定化など)
アッセイストラテジーについて一般的な注意点
膜タンパク質の固定化、アッセイのストラテジーについても多くの点を考える必要があります。
膜タンパク質の固定化においては、pHの変動にセンシティブなことが多いため、アミンカップリングを避け、タグや抗体を介したキャプチャー法が推奨されます。膜抽出物などクルードなサンプル中に含まれる特定の膜タンパク質のみを固定化したい場合は、タグや抗体を介してセンサーチップ表面上で簡易精製することができます。アミンカップリングで固定化する場合には、結合活性サイトを保護するように低親和力のアナライト存在下で固定化する方法があります。
また再生条件を決めることも困難ですので、毎サイクルでフレッシュな膜タンパク質をキャプチャーしなおす、キャプチャー法が良いです。例外として再生を行わない低分子スクリーニングなどの実験をしたいときは必ずしもキャプチャー法でなくとも構いません。
さらに非特異的な結合が出やすいため、ランニング緩衝液を最適化したり、固定化量を可能な限り少なくしたり、異なるセンサーチップで試す必要があります。使用するボトル類にも気を配り、ランニング緩衝液を充填する前には50mM NaOHでガラスボトルを洗浄しておくと良いでしょう。
界面活性剤で可溶化
膜タンパク質の機能的な活性を維持するためにはリン脂質二重膜に囲まれている必要があります。細胞膜に埋め込まれた膜タンパク質を界面活性剤で可溶化するプロセスでは、膜の脂質成分を破壊しながらタンパク質成分を非天然の界面活性剤で包まれた環境に置くことを目的としていますので、非常にデリケートな操作です。うまく可溶化できたとしても膜タンパク質本来の脂質環境を奪ってしまうため、一般的に脂質やほかのタンパク質とのネイティブな相互作用が失われてしまいがちです。しかしながらうまく行っているケースも報告されています。
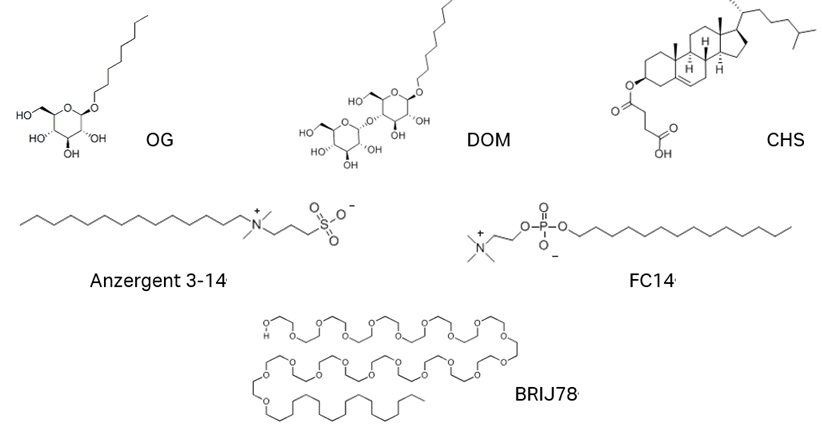
細胞膜から膜タンパク質を可溶化させるための緩衝液についてはケースバイケースとなり、広範で経験的なスクリーニングアプローチが必要です(Arachea et al.2012; Privé 2007)が、これまでの経験からいくつかの代表的な界面活性剤が見つかっています(Moraes et al.2014; Privé 2007; Seddon et al.2004)。全てCMC(臨界ミセル濃度)以上で用います。
最後のMagic GPCR mixtureは参考文献中で推奨されていた緩衝液です。
- OG n-octyl-b-D-glucopyranoside
- DOM n-dodecyl-D-maltopyranoside
- CHS cholesteryl hemisuccinate tris salt
- Anzergent 3-14
- FC14 Fos-choline-14
- BRIJ78
- Magic GPCR mixture
0.5% CHAPS, 0.1% DDM, 0.1% CHS, 50mM Tris, 200mM NaCl, 30% glycerol
Heiko Heerklotz, Biozentrum, Switzerland. At Biophysical Society 2007 : Membrane solubilization on the way from arts to routine technology
Acid Sensing Ion Channel 1a
この研究では完全に界面活性剤だけで可溶化しておらず、界面活性剤と脂質を複合化した方法で可溶化された膜タンパク質ASIC1aに対して47種類の低分子化合物をプレスクリーニングする目的で実施されています。膜タンパク質、ダミータンパク質、リポソームに対して化合物をある一定の濃度で添加することで、それらをa) 結合候補分子、b) 結合しない分子、c) 非特異的結合候補分子、の3つのグループに分類し、「問題ある(stickyな)」化合物を除去しています。更に結合候補分子は様々な濃度で添加しAffinity screen解析されています。
本研究は、冷凍された細胞ペレットを融解・界面活性剤で可溶化したのちに遠心操作にて細胞デブリを除去、その上清をそのままBiacore™でアプライしてタグ抗体(ロドプシンタグ抗体)やNTAを介して簡易精製・キャプチャーしています。キャプチャーされた膜タンパク質に対してコントロール化合物を添加し、経時的な結合活性の変化を24時間にわたり確認したり、CM4やCM5、L1チップにダミータンパク質やリポソームを用いて非特異的な結合をする化合物を確認したりする点など、膜タンパク質の測定のエッセンスが詰まった研究となっています。
参考
Development of a label-free biosensor method for the identification of sticky compounds which disturb GPCR-assays, Uppsala University, Disciplinary Domain of Science and Technology, Biology, Biology Education Centre. DiVA, 2013, p45
On-Surface Reconstitution法(OSR法)による膜タンパク質の固定化
先ほどのASIC1aは界面活性剤と脂質膜が混在したミセルをキャプチャーして測定していました。以下に示すOn-Surface Reconstitution(OSR)法では、完全に界面活性剤を追い出し脂質のみで再構成させています。OSR法ではSensor Chip L1に可溶化した膜タンパク質をアミンカップリング法でデキストラン上に固定化後、チップ表面の界面活性剤を脂質に置換して膜タンパク質を脂質二重膜に埋め込みます。
最近ではあまり用いられない方法です。
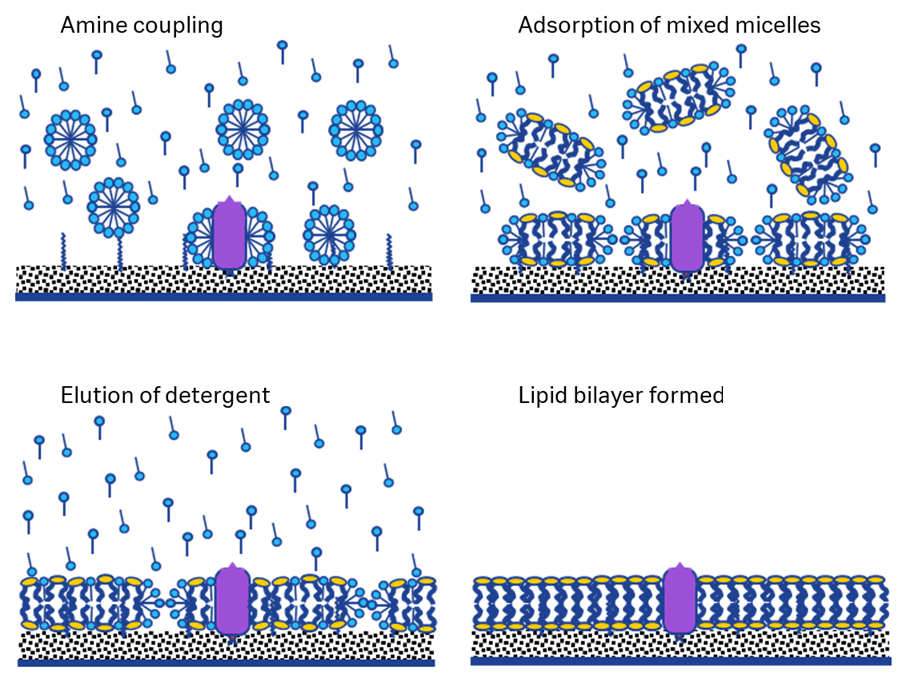
Hisタグ膜タンパク質のようにタグを有する場合には、Sensor Chip L1に抗His抗体をアミンカップリング法で固定化後、可溶化膜タンパク質をキャプチャーする方法も使用できます。その他のタグを有する膜タンパク質の場合にも同様です。
Sensor Chip L1は、Sensor Chip CM5に長鎖アルカンが導入された親水性と疎水性が混在した表面のチップですが、疎水性が高いためあらゆる物質が表面に吸着します。実験を開始する前には必ずDesorb & Sanitizeを実施し、使用するランニング緩衝液(HBS-NやPBSなど、界面活性剤を含まないもの)で一晩Standby状態にしておくと良いでしょう。
細胞膜様の環境下で可溶化
膜タンパク質を界面活性剤だけ、あるいは界面活性剤と脂質を複合化した方法で可溶化したり、可溶化後に脂質を吸着させ界面活性剤を追い出す方法とは異なり、人工的な細胞膜様の環境下で可溶化し測定する手法について述べていきます。
代表的な方法としてはAmphipols、Nanodisc、Virus like lipoparticles(VLP)の他、SMALPといった技術が挙げられます。
Amphipols
Amphipolsは高い親水性領域を持つ短い両親媒性のポリマー(10kDa程度)です。界面活性剤で細胞膜を破壊し膜タンパク質を可溶化後にAmphipolsで置き換えます。ビオチン標識された製品もあり、Sensor Chip SAを用いた測定例があります。
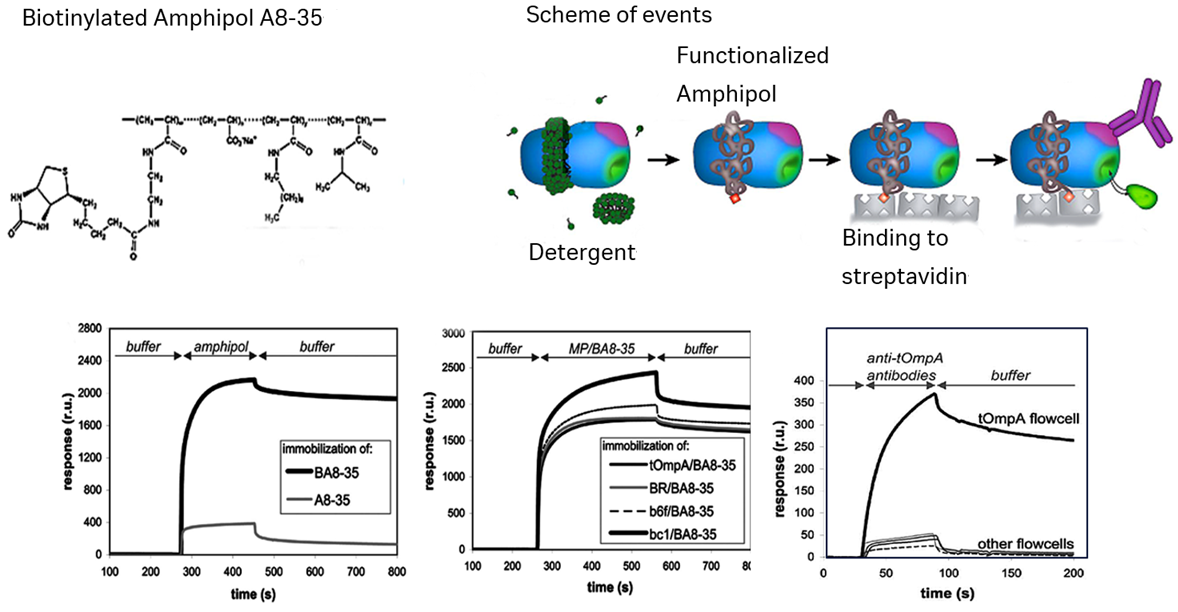
参考
The use of amphipols as universal molecular adapters to immobilize membrane proteins onto solid supports, Delphine Charvolin, Jean-Baptiste Perez, Florent Rouviere, Fabrice Giusti, Paola Bazzacco, Alaa Abdine, Fabrice Rappaport, Karen L. Martinez, and Jean-Luc Popot. PNAS January 13, 2009 vol. 106 no. 2 405–410
Reprinted from PNAS with permission
Nanodisc
Nanodiscは2つの膜骨格タンパク質(Membrane Scaffold Proteins: MSP)のベルトとリン脂質約150分子から構成される、天然に近いリン脂質二重膜構造を取るナノ構造体です。膜骨格タンパク質はApoipoprotein A-1を元に設計されているため、両親媒性の特徴を持ち、様々なターゲットタンパク質が組み込めるようになっています。
Nanodiscの厚さは使用したリン脂質の種類に依存しますが、典型的には4.5-5.6nmです。膜骨格タンパク質、界面活性剤に溶解した膜タンパク質、およびリン脂質を混合してインキュベートしたのちに透析などで界面活性剤を除去して使用します。
Nanodisc内での受容体の安定性は、DDMミセル存在下での安定性と比較して向上したことを実証しています。
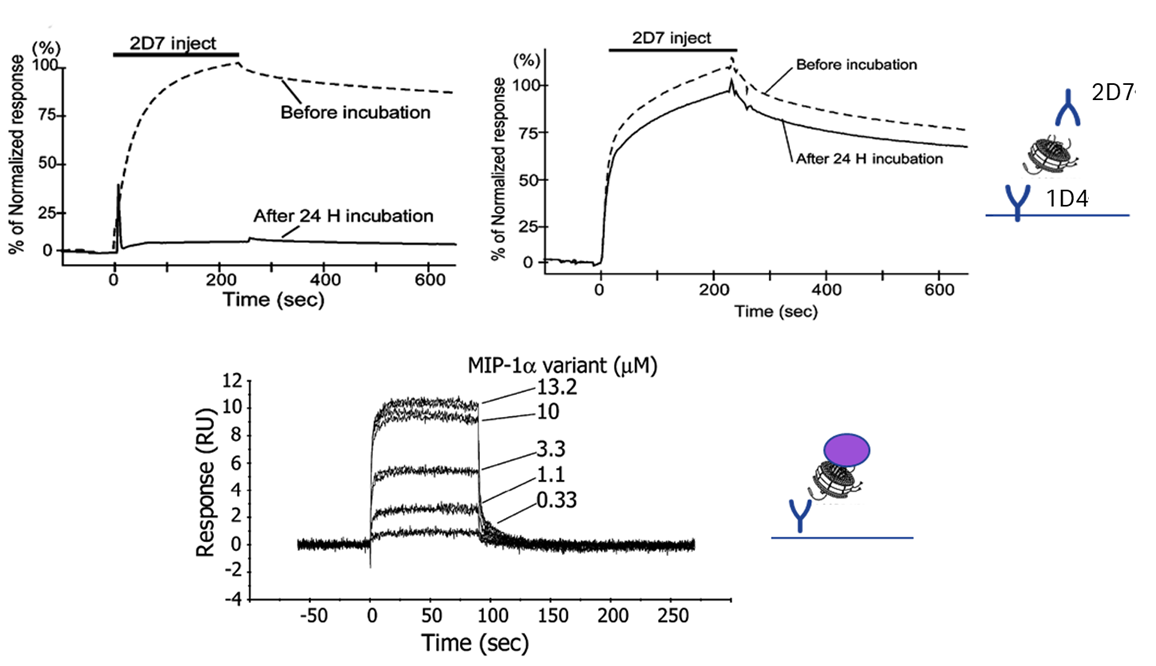
参考
NMR Analyses of the Interaction between CCR5 and Its Ligand Using Functional Reconstitution of CCR5 in Lipid Bilayers. Chie Yoshiura, Yutaka Kofuku, Takumi Ueda, Yoko Mase, Mariko Yokogawa, Masanori Osawa, Yuya Terashima, Kouji Matsushima and Ichio Shimada. J. AM. CHEM. SOC. 2010, 132, 6768–6777
Reprinted from JACS with permission
Virus like lipoperticles(VLP)
レトロウイルスの出芽システムをベースに形成された、感染力のないウイルス様粒子です。コアタンパク質としてGagを有し、目的膜タンパク質を発現させた宿主細胞を介して出芽させます。この脂質粒子の構造はレトロウイルスとほぼ同じですが感染性はありません。宿主細胞の脂質二重膜をそのまま用いるため、VLPの膜タンパク質は正しい配向性を保持します。
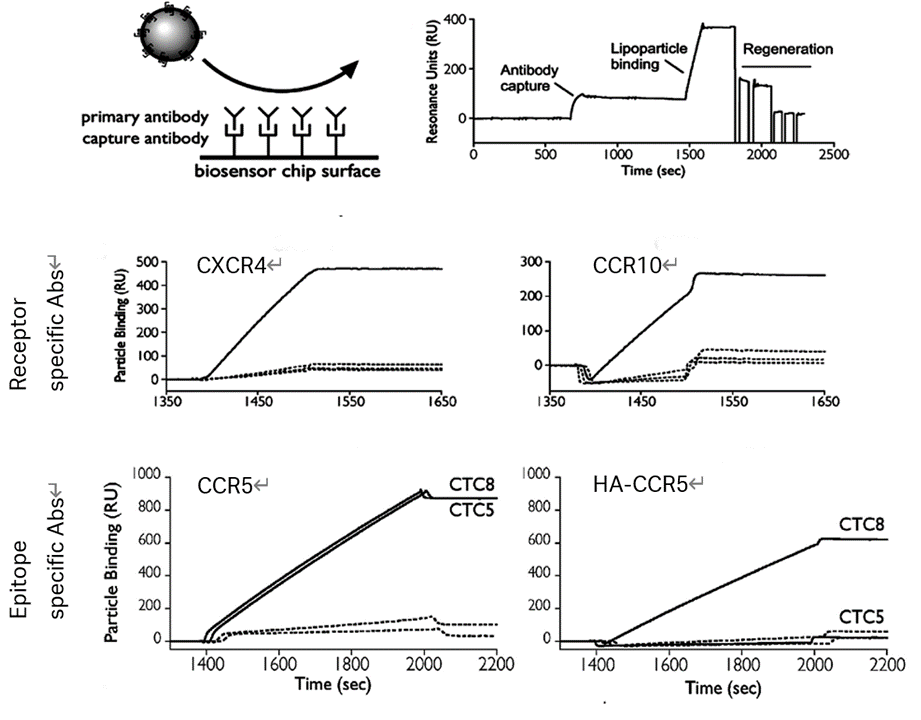
参考
Virus-like Particles as Quantitative Probes of Membrane Protein Interactions. Sharon Willis, Candice Davidoff, Justin Schilling, Antony Wanless, Benjamin J. Doranz, and Joseph Rucker. Biochemistry 2008, 47, 6988–6990
Reprinted from Biochemistry with permission
SMALP
膜タンパク質の新しい有望なツールとして、スチレン-マレイン酸共重合体(SMA)による膜タンパク質の界面活性剤不要の可溶化が挙げられます。この両親媒性分子は、小さなディスク状に脂質二重膜を可溶化することが可能です。
本論では副甲状腺ホルモン受容体PTH1Rのデカヒスチジンタグ付きバリアントをExpi293細胞で発現させ、SMAで可溶化・精製させた後に、抗His抗体を固定化したチップにキャプチャー氏、scFvとの相互作用を確認しています。
参考
Kaushik Sarkaret al. (2019)."Modulation of PTH1R signaling by an ECD binding antibody results in inhibition of β-arrestin 2 coupling", Nature Research 9: :14432
こちらも合わせてご覧ください。
SMALP network
Eur Biophys J (2016) 45:3–21
細胞膜中の膜タンパク質を使用(細胞を固定化など)
非常に直接的なアプローチですが、高感度の装置と、特異性の高い系が必要になります。過去に実施したCytiva webinar 「Biacore™で粒子を測定する」でご案内しましたように、そもそもSPRの測定系には細胞の測定はあまり向きません。
それでも測定する場合、課題としては以下の2点が挙げられます。
- 受容体の密度は低くなりがちで、Rmaxは小さくなってしまう
- 複数の膜タンパク質や膜そのものとアナライトが非特異的に結合するといった特異性の問題
実施例としては以下などが挙げられます。
| Target | Membrane | Chip / Immobilization | Analyte | Reference |
|---|---|---|---|---|
| CXCR4 | Murine Leukemia Virus-particles | Sensor Chip CM3 / Amine coupling | Gp120 & mAb | Hoffman et al. (2000) Proc. Natl. Acad. Sci. USA 97, 11215-20 |
| CD30 | Cell membrane vesicles | Sensor Chip L1/ hydrophobic capture | mAbs | Klimka et al. (2004) Int. J. Mol. Med. 14, 765-8 |
| SecYEG | Inner membrane vesicles | Sensor Chip L1/ hydrophobic capture | SecA & proOmpA | Keyzer et al. (2003) J. Biol. Chem. 278, 29581-6 |
| MtOM-Porin | Biotinylated proteoliposomes | Sensor Chip J/ biotin capture | Creatin kinase | Schlattner et al. (2001) J. Biol. Chem. 276, 48027-30 |
参考文献
膜タンパク質を界面活性剤で可溶化
- Rich RL, Miles AR, Gale BK and Myszka D. (2009). Detergent screening of a G-protein-coupled receptor using serial and array biosensor technologies. Analyt. Biochem. 386, 98-104.
- Schröder-Tittmann K, Bosse-Doenecke E, Reedtz-Runge S, Ihling C, Sinz A, Tittmann K. and Rudolph R. (2010). Recombinant expression, in vitro refolding and biophysical characterization fo the human glucagon-like peptide-1 receptor. Biochemistry vol 49 no 36, 7656-7965.
- Cook BL, Steuerwald D, Kaiser L, Graveland-Bikker J, Vanberghem M, Berke AP, Herlihy K, Pick H, Vogel H. and Zhang S. (2009) PNAS vol 106 no 29, 11925-11930.
- Karlsson, O (GE) in collaboration with Miller, D (Merck), unpublished. Binding of small molecules to the nuclear membrane protein FLAP.
- Navratilova I, Dioszegi M. and Myszka D. (2006). Analyzing ligand and small molecule binding activity of solubilized GPCRs using biosensor technology. Analyt. Biochem. 355, 132-139.
- Stenlund P, Babcock GJ, Sodroski J. and Myszka D. (2003). Capture and reconstitution of G protein-coupled receptors on a biosensor surface. Analyt. Biochem. 316, 243-250.
- Charvolin D, Perez J-B, Rouviere F, Giusti F, Bazzacco P, Abdine A, Rappaport F, Martinez KL and Popot J-L (2009). The use of amphipols as universal molecular adapters to immobilize membrane proteins onto solid supports. PNAS vol 106 no 2, 405-410.
細胞膜様の環境下で可溶化
Nanodisc
- Glück JM, Koenig BW and Willbold D (2011). Nanodiscs allow the use of integral membrane proteins as analytes in surface plasmon resonance studies. Analyt. Biochem. 408, 46-52.
- Yoshiura C, Kofuku J, Ueda T, Mase Y, Yokogawa M, Osawa M, Terashima Y, Matsushima K and Shimada I (2010). NMR analyses of the interaction between CCR5 and its ligand using functional reconstitution of CCR5 in lipid bilayers. J Amer. Chem. Soc. 132, 6768-6777.
Virus-like lipoparticles
- Willis S, Davidoff C, Schilling J, Wanless A, Doranz BJ and Rucker J (2008). Virus-like Particles as Quantitative Probes of Membrane Protein Interactions. Biochemistry 47, 6988-6990.
膜タンパク質の可溶化ドメインや変異体を使用
膜タンパク質の可溶性の細胞外または細胞内ドメインは、Biacore™において通常のタンパク質を取り扱うように測定可能です。また、特定の機能ドメインを模した合成ペプチドでの測定も可能です。もちろん、可溶性の細胞外ドメインがそのまま膜タンパク質と同じ結合特性を示す保証はありません。
例えばExendin-4はグルカゴン様ペプチド-1受容体の全長と細胞外N末端ドメインとの間で異なる結合を示しましたが、β-secretase 1(BACE1)は受容体の前兆と細胞外ドメインとの間で同様の結合を示しています。また可溶性タンパク質のドメインを使用せずにバッファー中での構造の安定性を向上させた変異体が利用された例もあります(Rich et al, 2011)。本文では特にご紹介いたしませんでしたが、ここでは参考文献だけ掲載いたします。
- Lin H, Lee E, Hestir K, Leo C, Huang M, Bosch E, Halenbeck R, Wu G, Zhou A, Behrens D, Hollenbaugh D, Linnemann T, Qin M, Wong J, Chu K, Doberstein S and Williams LT (2008). Discovery of a cytokine and its receptor by functional screening of the extracellular proteome. Science 320, 817-811.
- Monfregola L, Vitale RM, Amodeo P and De Luca S (2009). A SPR strategy for high-throughput ligand screenings based on synthetic peptides mimicking a selected subdomain of the target protein: A proof of concept on HER2 receptor. Bioorganic and Medicinal Chemistry 17, 7015-7020.
- Rich RL, Errey J, Marshall F and Myszka D (2011) Biacore™ analysis with stabilized G-protein-coupled receptors. Analyt. Biochem. 409, 267-272.
<(参考)OSR法の一例>
本文に記載した通り、あまり最近では用いられない方法です。
準備する試薬類
| センサーチップ | Sensor Chip L1 |
| ランニング緩衝液 | HBS-NやPBSなどの界面活性剤を含まない緩衝液 |
| キット | Amine coupling kit |
| リガンド希釈液 | 10mM Acetate、20mM n-Octyl-β-glucosideなど |
| ブロッキング試薬 | 1M ethanolamine hydrochloride pH8.5、20mM n-Octyl-β-glucosideなど |
| 基材脂質 | 10mM POPC in 100% クロロホルム |
| 混合ミセル用界面活性剤溶液 | 20-40mM n-Octyl-β-glucoside in HBS-N(HBS-OG、0.5M n-Octyl-β-glucosideのストック溶液と10X HBS-Nを使用して調製) |
| リガンド | 0.5μM 可溶化膜タンパク質 |
| 洗浄試薬 | 40mM n-Octyl-β-glucoside、50mM CHAPS |
| エバポレータ | |
| 真空ポンプ |
混合ミセル溶液の調製
10mM POPC in 100% クロロホルムを、メスフラスコ(または平底のガラス瓶)に取ります。「3」の段階で、終濃度が0.1-10mMになるように容量を調製してください。
※きれいなメスフラスコまたはガラス瓶を使用してください。事前にクロロホルムで洗浄してください。
- エバポレータで減圧乾燥して、さらに真空ポンプで2時間乾燥させます。
- 「2」に、20-40mM HBS-OGを添加して、終濃度0.1-10mM POPCに調製します(検討結果から、27.5 mM n-Octyl-β-glucoside、3.75mM POPC溶液で、脂質膜の構築効率が良いことが確認されています)。10分ごとにボルテックスにかけながら45分間室温に置きます。ガラス壁に脂質が残っていないことを確認してください。
混合ミセルが調製できたかを確認するには、未処理のSensor Chip L1表面を使用します。センサーチップ表面を50mM CHAPSを1分間、2回添加してコンディショニングを実施後、混合ミセル溶液を5-10μL/minで1-8分間添加します。次の溶液を添加する際には40mM n-Octyl-β-glucosideを1分間、2回添加してください。POPCミセルでは、3000-6000 RU固定化されます。
界面活性剤の混合割合が高いと、脂質が固定化できません。逆に脂質の混合割合が高いと脂質の固定化速度が遅くなります。
リガンドの調製
終濃度0.5μM程度になるよう、リガンド希釈液で希釈します。
固定化プロトコール
| 流速 | 10μL/min |
| センサーチップ洗浄試薬 | 40mM n-Octyl-β-glucoside、1分間、2回 |
| NHS/EDC | 7分間 |
| リガンド溶液 | 14分間 |
| ブロッキング試薬 | 7分間 |
| 混合ミセル溶液 | 2分間 |
- 混合ミセル溶液添加後は、界面活性剤を含まないランニング緩衝液が流れることで、センサーチップ上の界面活性剤は溶出して、脂質膜が再構成されます。
- リファレンスセルには、基材となる脂質を固定化してください。
参考
Karlsson, O. P. et al. (2002). “Flow-mediated on-surface reconstitution of g-protein coupled receptors for applications in surface plasmon resonance biosensors.” Anal Biochem 300(2):132-8. PMID: 11779103
キャプチャー法を利用したOSR法:CXCR4とSDF-1
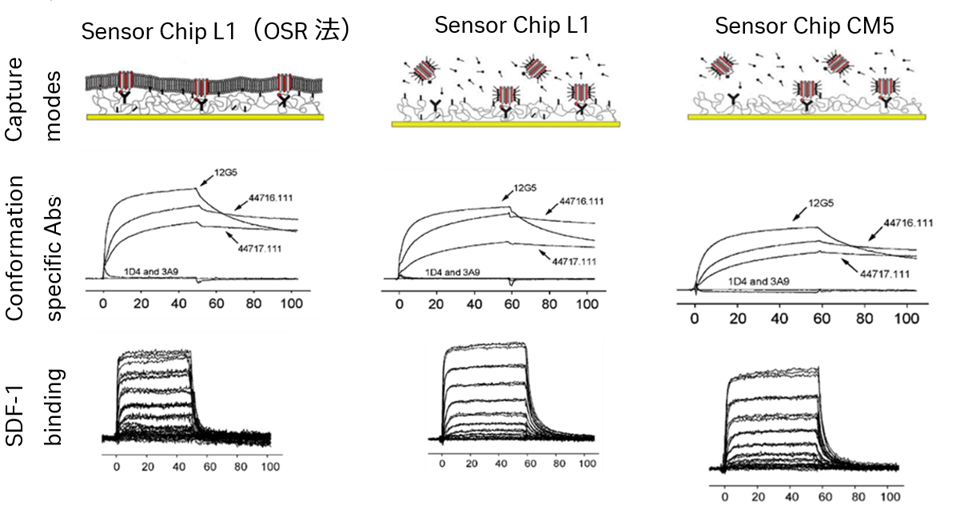
本研究では2つのケモカイン受容体であるCXCR4とCCR5をモデルとしています。CXCR4およびCCR5は1D4抗体と結合できるC9タグと共にCf2Th細胞表面上に発現させました。おおよそ2 x 106 cellsを180μLの可溶化バッファー(20mM Tris, pH 8.5, 0.1M (NH4)2SO4, 10% glycerol, protease inhibitor tablet per 50 ml buffer, 更に界面活性剤として 1% Chapso もしくは Triton X-100)で可溶化し、遠心操作にて細胞デブリを除去し上清を回収しました。続いてSensor Chip L1やCM5にアミンカップリング法で1D4抗体を固定化し、その上に先ほどの上清を添加しキャプチャーさせています。ケモカイン受容体のコンフォメーション状態を特異的な抗体を用いて調べ、さらにネイティブなケモカインリガンドであるSDF-1を用いて結合特性を調べました。
この結果、界面活性剤で可溶化した受容体は、脂質二重膜再構成の存在下でも非存在下でもSDF-1に対する活性を維持していることが確認されました。このキャプチャー法の利点としては以下が挙げられます。
- チップ表面に固定化する前に膜タンパク質を精製する必要がない
- キャプチャーされる段階で膜タンパク質を均一に固定化できる
参考
Stenlund, P. et al. (2003). “Capture and reconstitution of G protein-coupled receptors on a biosensor surface.” Anal Biochem 316(2): 243-50. PMID: 12711346