この記事は、自動翻訳ソフトウェアによって翻訳されています。自動翻訳によって生成された記事(Cytivaにより見直された記事を含む)には、単語、構文、文法などの間違いが含まれている場合があります。弊社は、コンテンツの不正確な翻訳またはその使用により生じる間違いや誤解、または損傷に対して責任を負いかねます。あらかじめご了承ください。
By Anna Ucher, University of Massachusetts
遺伝子治療のデリバリーシステムとして、rAAV5セロタイプなどの組換えアデノ随伴ウイルスベクター(rAAV)が広く評価されています。本稿では、HyClone™ peak expression mediumが組換えタンパク質生産をどのように促進するかを紹介します。Xcellerex™ XDR-10およびXDR-200バイオリアクターを用いてHyClone™ peak expression mediumでのプロセスの拡張性を調べ、その性能をシェイクフラスコ培養と比較しました。HyClone™ peak expression mediumは、HEK293懸濁細胞において増殖、生存率、rAAV生産性の向上を示しました。
はじめに
rAAVベクターは、嚢胞性線維症や血友病Bなどの遺伝性疾患の修正を目的とした前臨床試験および臨床試験において、遺伝子治療デリバリーシステムとして評価されている(1)。安全性と生産性を高め、より効果的な治療法を生み出すために、何世代ものrAAVが開発されてきました(2)。しかし、AAV5セロタイプは臨床研究において一般的であり、rAAVのプロセス開発に適したモデルとなっています。
ヒト胚性腎臓(HEK293.2sus)細胞株は、パッケージング細胞株として、プラスミド 3重導入によるrAAV5 生産をサポートしています。しかし、最適な細胞性能は、特定の細胞クローンの成長および生産性、培養液の組成、ならびに撹拌、通気および温度などの培養条件などのいくつかの要因に依存する。これらの要因が代謝プロセスにどのような影響を与えるかを理解することは、細胞培養液を設計する際に不可欠である。細胞株の代謝活性、栄養要求量、廃棄物生成に関する知識は、細胞毒性につながる廃棄物生成を最小限に抑えるために、正しい栄養の組み合わせと量を使用することに役立ちます。
一過性のトランスフェクションや細胞増殖のサポート
HyClone™ peak expression mediumは、組換えタンパク質生産を促進する、タンパク質および動物由来成分を含まない培地です。この培地は、高い生細胞密度(VCD)による増殖、様々な組換えタンパク質の発現のための一過性トランスフェクション、および懸濁培養におけるHEK 293.2 sus細胞の生産性をサポートするために開発されました。
HyClone™ peak expression mediumで培養したHEK 293.2 sus細胞をシェイクフラスコ培養し、細胞増殖、生存率、rAAV生産性を評価した。Xcellerex™ XDR-10およびXDR-200バイオリアクターで改良培地を用いてプロセスのスケーラビリティを調査し、シェイクフラスコ培養と性能を比較しました。
細胞培地への馴化
HEK 293.2 sus細胞(ATCC)をHyClone™ peak expression mediumに馴化させました。細胞馴化は、BalanCD™ HEK293 培地(Fujifilm Irvine Scientific)で培養した細胞を、種細胞密度 5.0 × 105 cells/mL を用いて直接移植することにより行った。この細胞は3〜4日ごとに再培養した(d)。細胞の再培養は、室温で新鮮な培地を加えることによって行われました。細胞の再培養は、細胞が24時間から30時間の間の集団分裂時間(PDT)に達し、細胞生存率が90%以上となるまで続けました。
シェイクフラスコ培養
HEK293.2 sus 細胞をHyClone™ peak expression medium30~50 mLに播種し、125 mLシェイクフラスコに細胞密度 0.4 ×106 cells/mL でセットしました。培養は140 rpm、37°C、5% CO2 の条件下でシェーカーインキュベーターを用いて行いました。細胞数および生存率が低下し始めたら培養を終了しました。細胞培養は3回に分けて行っています。
ウイルスの増殖
細胞培養は、3重プラスミド・トランスフェクション・システムを使用して、3つのプラスミドでトランスフェクションされました。このシステムは、アデノウイルス遺伝子を送達するpHelperプラスミド、Rep/Cap(複製およびキャプシドタンパク質)プラスミド、およびAAVキャプシドへのパッケージ化に不可欠な逆末端反復配列(ITR)の間に目的の遺伝子(GOI、この場合は緑色蛍光タンパク質[GFP]が本研究で使用)を含む第3プラスミドから構成されています。ヘルパー:Rep/Cap:GOIプラスミドの比率は、2.0:1.5:1.0でした。線状ポリエチレンイミン(PEI、ポリサイエンス社)を用いて、2 × 106 cells/mL密度の培養で、2:1(PEI対DNA比)でトランスフェクションを誘導しました。トランスフェクション後4日目にTOHを行い、緑色蛍光タンパク質(GFP)導入遺伝子カセットに対する液滴デジタルPCR(ddPCR)によりウイルス力価を測定しました。
ウイルス力価
約900 µLの培養液を100 µLの10×溶解バッファー (5% Tween™ 20, 10 mM magnesium chloride, 200 mM Tris, pH 8.0) と20 U/mL のTurbonuclease酵素で37℃、4時間振とう培養した。このアリコートを15 000 × gで10分間遠心分離し、上清をddPCRで解析しました。
バイオリアクター培養
HEK 293.2 sus細胞をHyClone™ peak expression mediumに0.5 × 106 cells/mLの細胞密度でシングルユースのXcellerex™ XDR-10 L細胞培養バッグに播種し、最終バイオリアクターバッチ容量9 Lにした。表1に示す培養パラメータを用いてXDR-10バイオリアクターシステムで培養を実施しました。細胞培養は、シェイクフラスコからWAVE™ バイオリアクター(Xuri™ Cell Expansion System W25)を経て、XDR-200バイオリアクターで展開されました。
表 1. スケールアップ研究のためのバイオリアクター条件
| Parameter | XDR-10 bioreactor run | XDR-200 bioreactor run |
| Culture medium | HyClone™ peak expression medium | HyClone™ peak expression medium |
| Working volume | 9 L | 180 L |
| Impeller speed | 120 rpm (up-flow direction) | 158 rpm (up-flow direction) |
| Temperature | 37°C | 37°C |
| pH set point | 7.3 (controlled by CO2 and base) | 7.3 (controlled by CO2 and base) |
| Dissolved oxygen (DO) set point | 40% (controlled by oxygen enriched air) | 40% (controlled by oxygen enriched air) |
| O2 flow | Proportional integral derivative (PID) controlled | PID controlled |
| CO2 flow | PID controlled | PID controlled |
結果
HyClone™ peak expression mediumへの馴化
BalanCD™ HEK293培地(Fujifilm Irvine Scientific)でクローン選択したHEK293細胞をHyClone™ peak expression mediumで直接融解しました。3 ~ 4 日後、0.4 ~ 0.5 ×106 VC/mL に分割し、数継代にわたって培養を維持した。PDTと同様にVCDもモニターしました(Fig 1)。
細胞バンクは継代5で作成しました。細胞はジメチルスルホキシド(DMSO)入りHyClone™ peak expression mediumで凍結し、20 × 106 VC/mLに濃縮し、1 mLアリコートをクライオチューブに移しました。細胞バンクはCoolCell™容器(Cool Lab, LLC)に入れて-80℃で一晩凍結し、液体窒素保存槽に移しました。
複数のセルバンクのバイアルを解凍した後、VCDと集団倍加時間(PDT)をモニターして一貫性を確認しました(Fig 2)。
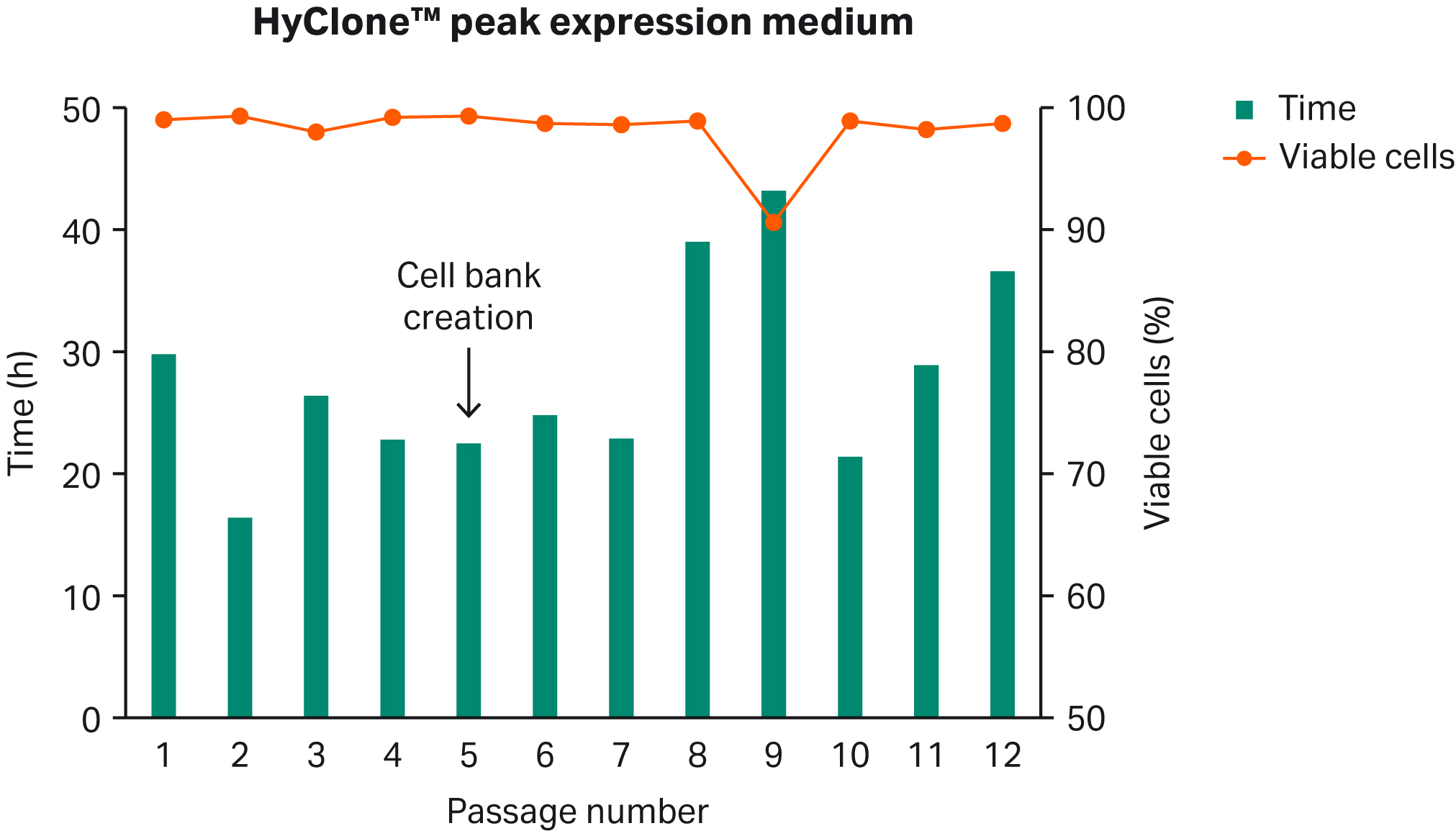
Fig 1. HEK 293細胞のHyClone™ peak expression mediumへの直接馴化。
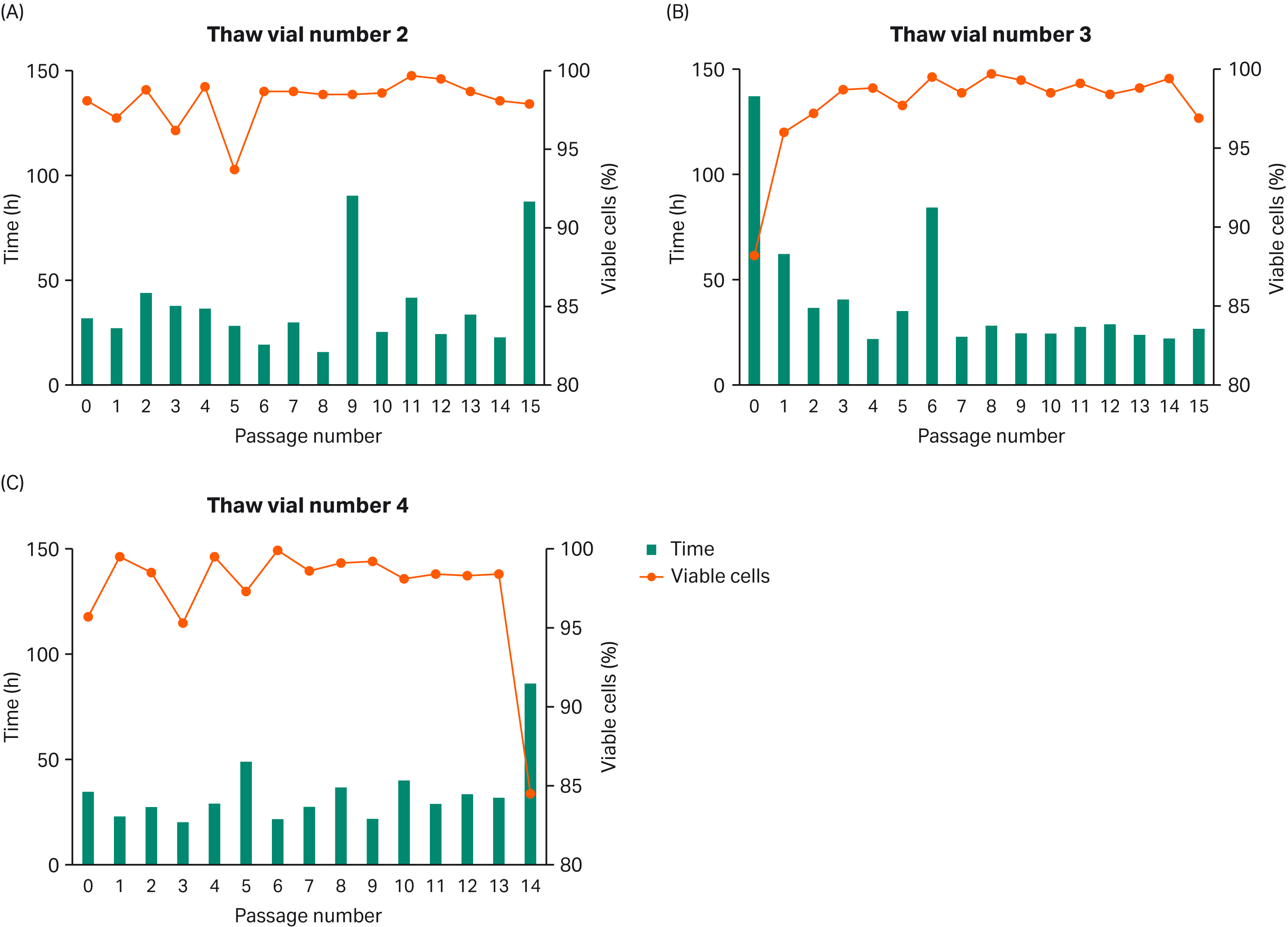
Fig 2. Passage 5からの複数の細胞バンクバイアルを解凍し、VCDとPDTをモニター。
シェイクフラスコでの高密度培養
この実験では、HyClone™ peak expression mediumを用いて、異なる継代の細胞をシェイクフラスコで最大13日間培養しました(Fig.3)。VCD、細胞生存率、PDTは終始モニターされました。Fig 3から、HyClone™ peak expression mediumは6.0から9.0 × 106 cells/mLの間で細胞増殖をサポートすることが分かります。
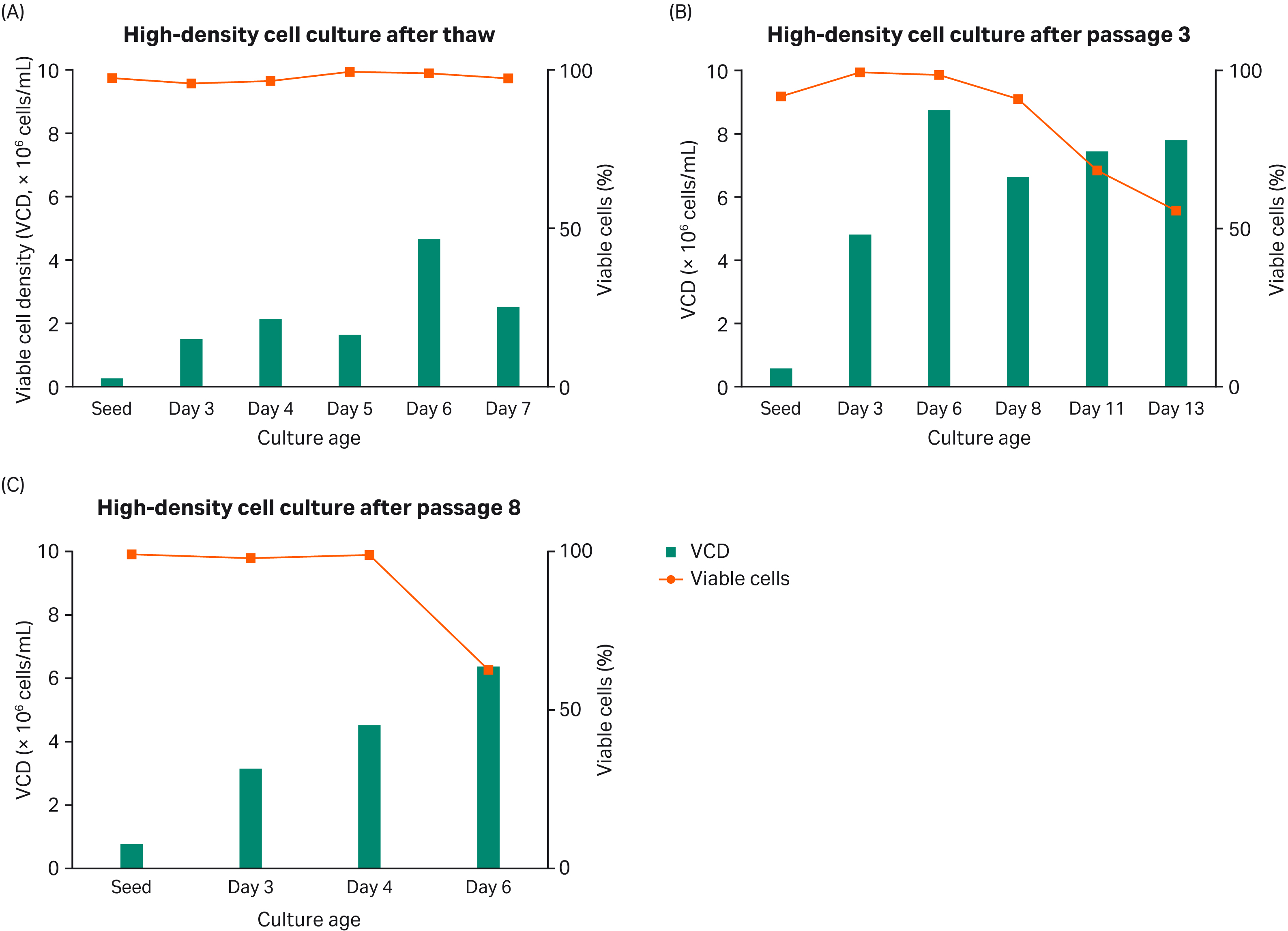
Fig 3. シェイクフラスコでの高密度細胞培養(A)、解凍後(B)、継代3回目以降、継代8回目以降(C)。
シェイクフラスコでの一過性トランスフェクションの最適化
馴化したHEK293懸濁細胞の一過性トランスフェクションは、三重プラスミドトランスフェクションアプローチを用いて行われた。この手順では、線状ポリエチレンイミン(PEI)がDNAと複合体を形成し、これを宿主細胞内に導入する。シェイクフラスコ内のHEK293浮遊細胞へのrAAV5-緑色蛍光タンパク質(GFP)のトリプルトランスフェクションには、2×106 /mL細胞あたり2μgのDNAが用いられました。
PEI-DNA複合体の安定性に及ぼす培地の影響を調べるために、HyClone™ peak expression mediumを、rAAV生産量全体の5%または10%の異なる複合化量で使用しました(Fig 4)。それぞれの条件はシェイクフラスコで3回ずつ行われた。10%の容量がより安定した測定を繰り返し、HyClone™ peak expression mediumを用いたHEK293浮遊細胞のrAAV生産実験に使用する推奨容量となります。
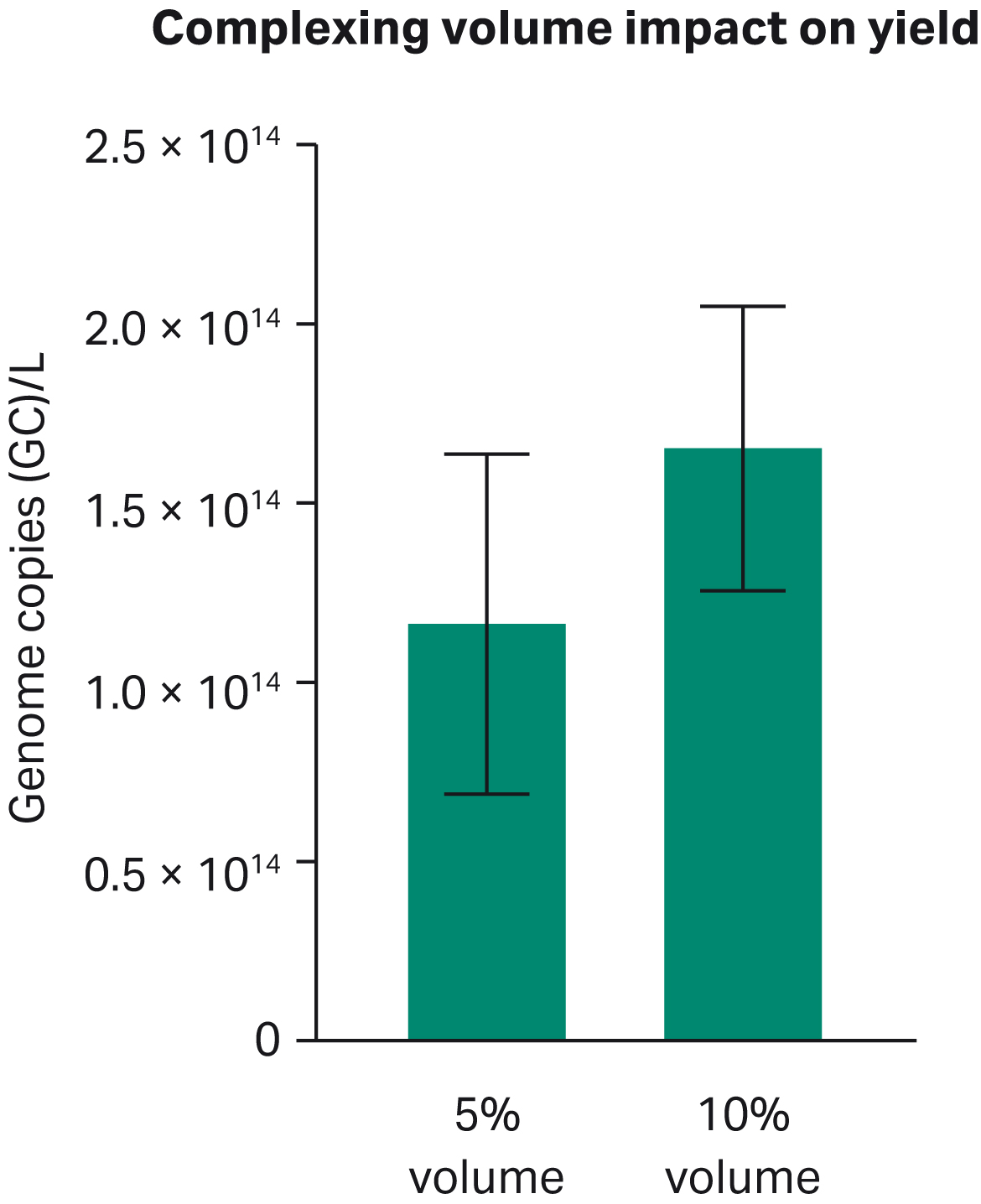
Fig 4. HyClone™ peak expression mediumを用いたシェイクフラスコにおいて、PEIとDNAの複合体形成量を5%と10%で比較した場合のトランスフェクション収率の違い。ゲノムコピー数=GC。
2つの培地におけるゲノムコピー収量の比較
HyClone™ peak expression mediumとBalanCD™ HEK293 medium (Fujifilm Irvine Scientific)の2種類の培地でrAAV5の生産性を評価しました。力価はGC/L(1リットルあたりのゲノムコピー数)で測定し、比較のために4つの複製を使用しました。
Fig 5に示すように、HyClone™ peak expression mediumでは、BalanCD™培地に比べてGC/Lが4倍増加した(p < 0.05)ことを確認しました。GC/cellの収量はBalanCD™培地では2.6 × 104 GC/cellであったのに対し、HyClone™ peak expression mediumでは6.8 × 104 GC/cellを観察し、これは2倍以上の増加に相当しました(データ示さず)。
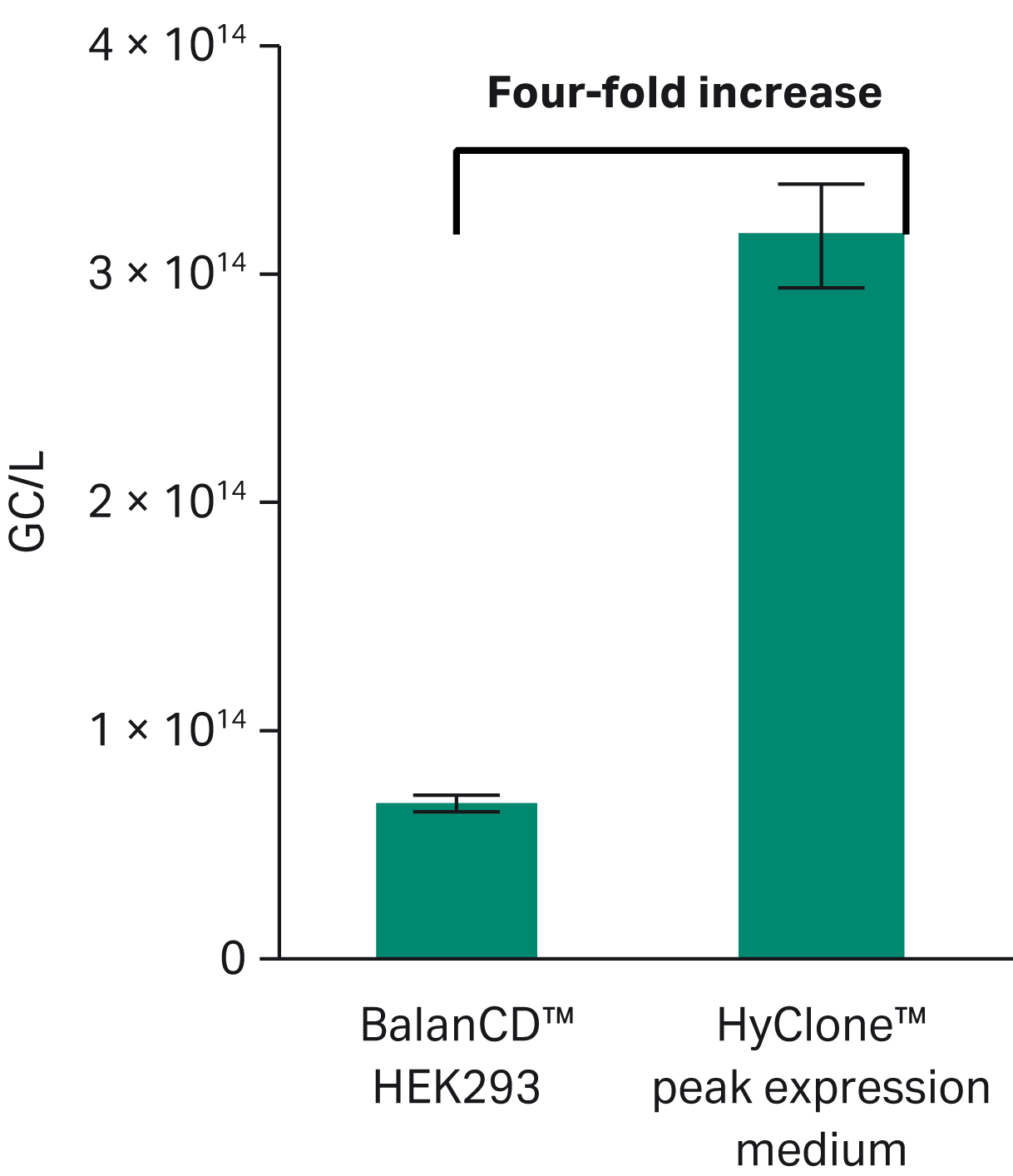
Fig 5. rAAV5-GFP生産におけるHyClone™ peak expression mediumとBalanCD™ HEK 293培地のゲノムコピー収量の比較(n = 4, p < 0.01).統計的評価はStudentのt-testを用いて行った。
バイオリアクターでのrAAV5製造のスケールアップ
最後に、Xcellerex™ XDR-10 バイオリアクターを用いてシェイクフラスコから 10 L 規模に、さらに XDR-200 バイオリアクター を用いて 200 L 規模に、rAAV5-GFP の生産性をスケールアップしました(Fig 6)。この結果は、シェイクフラスコ培養による収量の減少を伴うものの、このプロセスが 10~200 のバイオリアクタースケールでスケーラブルであることを示しています。GFPの割合は、トランスフェクション後48時間でピークに達しました(2d、データは示さず)。
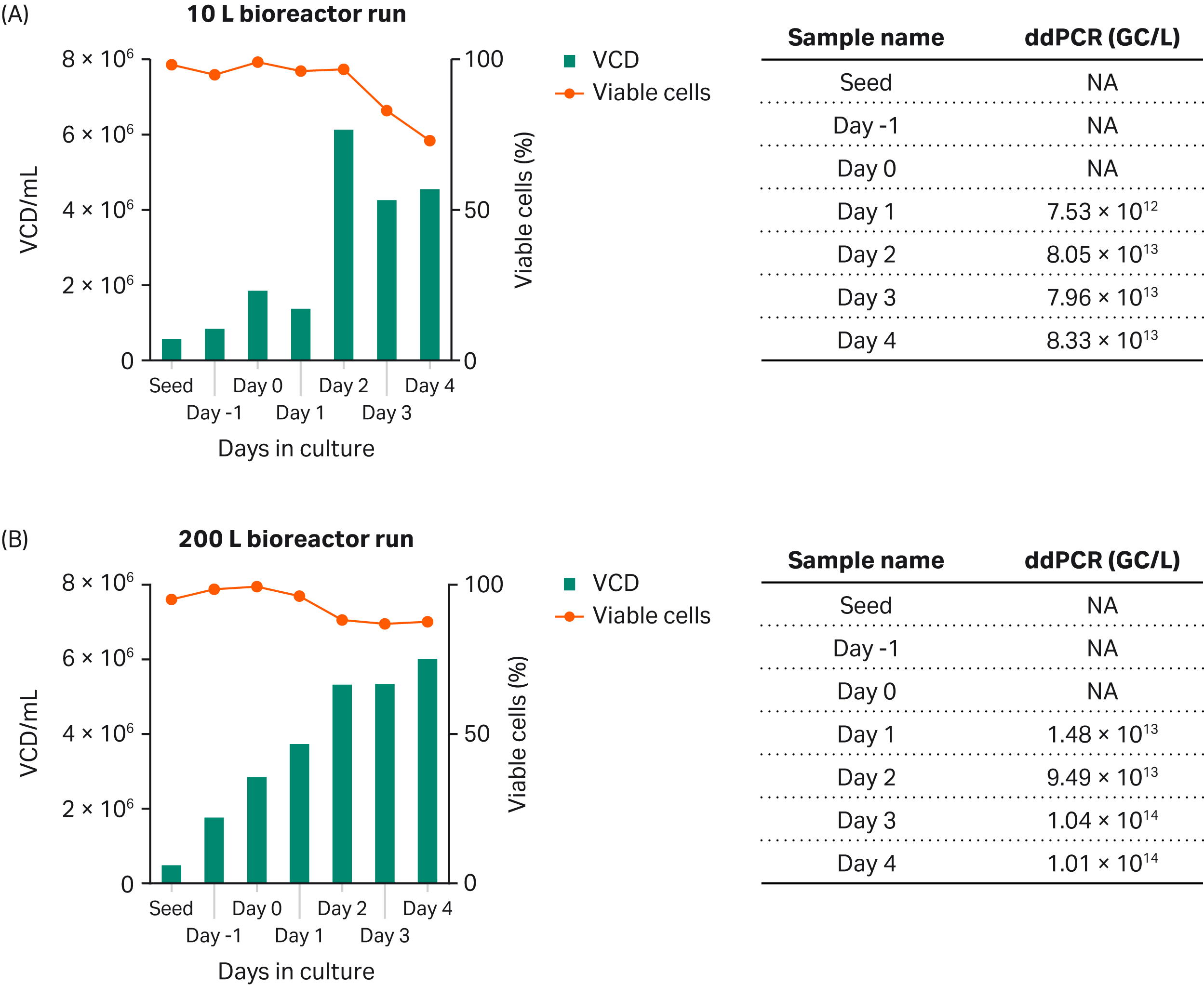
Fig 6. (A) XDR-10バイオリアクターを用いた10L培養と(B) XDR-200バイオリアクターを用いた200L培養でのrAAV5-GFPの生産。
完全培地におけるDNA-PEI複合体の形成
浮遊培養において凝集を避け、せん断応力を軽減し、細胞の成長を促進するために、ポラクサマーは培養液に頻繁に使用されています。その結果、PEIとDNAの複合体をPluronic™ F-68なしで行った場合、rAAVの生産量は1.8 × 1014 GC/L以下、Pluronic™ F-68を含む場合は1.8 × 1014GC/L 以上となりましたが、統計的に有意差はありませんでした(Fig 7)。
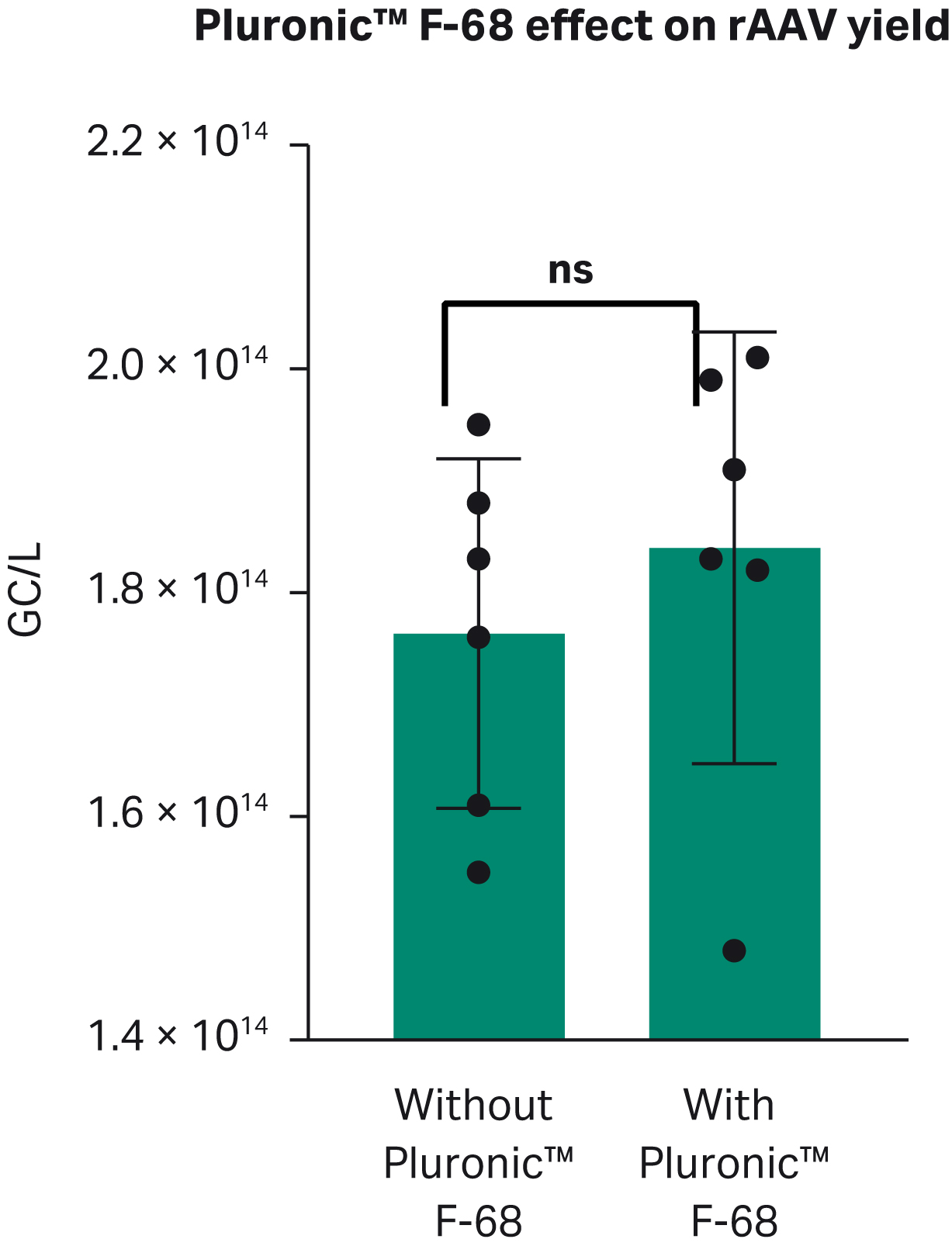
Fig 7. rAAVウイルス力価に対するPluronic™ F-68の効果。
結論
HyClone™ peak expression mediumについて、以下のことが確認されました。
- HyClone™ peak expression mediumの完全補充組成は、追加の培養材料を必要とせず、繰り返しの実験においてより強固で再現性の高いものとなっています。
- 凍結保存からの回復がよく、培養条件が安定している。
- シェイクフラスコで最大9.0×106 の細胞を高密度に培養し、rAAVのバッチ生産を可能にします。
- HyClone™ peak expression mediumを使用することにより、シェイクフラスコから200Lまでのスケールアップが可能です。
- BalanCD™ HEK293培地と比較して、rAAVの生産性が4倍高いことを確認しました。
- 生産量の10%で安定したDNA-PEI複合体形成が可能です。
- ポロキサマーはDNA-PEI複合体形成効果に影響を与えなかった。
生産性を向上させるためのAAVプロセスの開発・改良方法をご紹介します。
参考文献
(1) Mueller, C, Flotte, TR, Clinical gene therapy using recombinant adeno-associated virus vectors. Gene Ther. 2008;15(11):858-863. doi:10.1038/gt.2008.68
(2) Flotte, T, Gene therapy progress and prospects: Recombinant adeno-associated virus (rAAV) vectors. Gene Ther. 2004;11:805-810. https://doi.org/10.1038/sj.gt.3302233
CY26839-30Aug22-AN
お問合せフォーム
※日本ポールの他事業部取扱い製品(例: 食品・飲料、半導体、化学/石油/ガス )はこちらより各事業部へお問い合わせください。